年级:高三 科目:化学 教师:刘艳琴
高三年级第二次月考化学试卷
请将选择题的正确答案填涂在机读卡上。
有关相对原子质量: H: 1 C:12 O:16 Ag:108 Fe:56 S:32 Cu:64 Ne:20
一.选择题(本题包括25小题,每小题2分,共50 分。每小题只有一个选项符合题意)
1.“在火星上找到水存在的证据”位居《Science》杂志评出的2004年10大科技突破之首。下列关于水的说法中错误的是
A.水是生命活动必不可少的物质
B.水是由极性键构成的极性分子
C.水是一种极弱的电解质,温度越高电离程度越大
D.高效催化剂可使水分解获得氢气,同时释放能量
2.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
![]() A.一个D2O分子所含的中子数为8 B.热稳定性:H2S>HF
A.一个D2O分子所含的中子数为8 B.热稳定性:H2S>HF
![]() C.HCl的电子式为
D.NH3的结构式为
C.HCl的电子式为
D.NH3的结构式为
3.闪电时空气中有臭氧生成。下列说法中正确的是
A.O3和O2互为同位素 B.O2比O3稳定
C.等体积O3和O2含有相同质子数
D.O3与O2的相互转化是物理变化
4.下列反应的离子方程式书写正确的是
A.向澄清石灰水中加入过量的碳酸氢钠溶液 Ca2+ +OH- + HCO3- =CaCO3↓+H2O
B.F2与NaOH溶液反应:F2+4OH-==2F-+O2+2H2O
![]() C.碳酸钠溶液显碱性:CO32-
+2H2O
H2CO3 +2OH-
C.碳酸钠溶液显碱性:CO32-
+2H2O
H2CO3 +2OH-
![]()
| |
5.同主族两种元素原子的核外电子数的差值可能为
A.6 B.12 C.26 D.30
6.下列表述正确的是
①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅
②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A.③⑤ B.①②③ C.②④ D.③④⑤
7.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是
A.3 Cl2 + 6 FeI2 = 2FeCl3 + 4 FeI3 B.Cl2 + FeI2 = FeCl2 + I2
C.Co2O3 + 6 HCl = 2CoCl2 + Cl2↑+ 3H2O D.2Fe3+ + 2I— = 2Fe2+ + I2
8.阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定正确的是
A.1.0L 1.0mol·L—1CH3COOH溶液中,CH3COOH分子数为6.02×1023
B.Na2O2与H2O反应生成1.12LO2(标准状况),反应中转移的电子数为2×6.02×1022
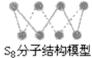 C.32g S8单质中含有的S-S键个数为6.02×1023
C.32g S8单质中含有的S-S键个数为6.02×1023
D.22.4L N2中所含的分子个数为6.02×1023
9.将0.03mol Cl2缓缓通入含0.02mol H2SO3和0.02mol HBr的混合溶液中(忽略溶液体积的变化)。溶液中c(H+)与通入的Cl2的物质的量的关系图中,正确的是
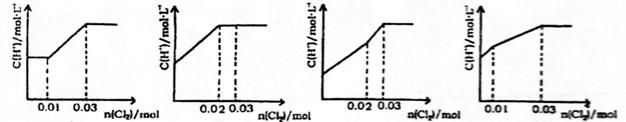
A B C D
10.在恒温、恒容条件下,有反应3A(g)+B(g) ![]() 3C(g);△H=QkJ/mol(Q<0)现从两条途径分别建立平衡:I A、B起始的物质的量分别为3mol和1mol,II C起始时物质的量为6mol,则下列叙述正确的是
3C(g);△H=QkJ/mol(Q<0)现从两条途径分别建立平衡:I A、B起始的物质的量分别为3mol和1mol,II C起始时物质的量为6mol,则下列叙述正确的是
A.达到平衡,II所放出的热量为I所放出热量的2倍
B.达到平衡,I的反应速率v(B)等于II的反应速率v(B)
C.I、II达到平衡时各自所得的混合气体平均式量相等
D.I、II达到平衡时,C的体积分数II大于I
11.下列实验操作正确的是
A.在酸碱中和滴定时,右手旋转滴定管的活塞,左手摇动锥形瓶,眼睛看滴定管中的液面
B.滴定管洗净后再用蒸馏水润洗,即可装入标准溶液进行滴定
C.将硝酸银溶液放于棕色细口瓶中保存
D.用托盘天平称1.06g碳酸钠固体配100 mL 0.1 mol·L-1碳酸钠溶液
12.下列离子方程式书写正确的是
A.烧碱和甲酸混合:OH-+H+=H2O
B.AgNO3溶液中加入过量氨水:Ag++2NH3·H2O==Ag(NH3)2++2H2O
C.Fe3O4与稀HNO3反应:Fe3O4+8H+==Fe2++2Fe3++4H2O
![]() D.稀(NH4)2SO4溶液中加少量稀NaOH溶液: NH4++OH NH3·H2O
D.稀(NH4)2SO4溶液中加少量稀NaOH溶液: NH4++OH NH3·H2O
13.将a LNH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b L(气体体积均在同温同压下测定),该b L气体中NH3的体积分数是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
14.有pH相同的三种一元酸HA、HB、HC各20mL,与过量的镁反应后,产生氢气的质量为:HC>HB=HA ,有以下说法,不正确的是
A.开始时反应速率相同
B.HC的酸性最弱
C.反应消耗镁的质量为HC>HB=HA
D.相同物质的量浓度的溶液,碱性大小为NaC<NaA=NaB
15.已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“一”。关于标有“+”的接线柱,下列说法中正确的是
A.充电时作阴极,放电时作负极 B.充电时作阳极,放电时作负极
C.充电时作阳极,放电时作正极 D.充电时作阴极,放电时放正极
16.温度相同、浓度均为0.2mol/L的①(NH4)2SO4②NaNO3③NH4HSO4④NH4NO3⑤![]() -ONa⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是
-ONa⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是
A.③①④②⑥⑤ B.①③⑥④②⑤ C.③②①⑥④⑤ D.⑤⑥②④①③
![]() 17.下列说法正确的是
17.下列说法正确的是
A.分别由 组成的金属钛单质互称为同素异形体
B.20g氖气含有6.02×1023个原子
C.用铁跟稀硫酸反应制氢气加入少量CuSO4可防止反应过快
D.把16.0g无水硫酸铜粉末投进足量饱和硫酸铜溶液中会析出25.0g晶体
18.X、Y、Z、W为四种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价的代数和为6;Z在地壳中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+2。下列说法正确的是
A.X、Y、Z、W的原子序数依次增大
B.Y不能把溴从溴化物中置换出来
C.Z的氧化物通常形成分子晶体
D.存放W单质的仓库失火不能用CO2灭火
19.下列有关化学反应速率的说法正确的是
A.用铁片和稀硫酸反应制取氢气时,改用98﹪的浓硫酸可能加快产生氢气的速率
B.100mL 2mol/L的盐酸跟锌片反应时,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO反应转化为无害的N2和CO2,减小压强,反应速率减慢
20.在含有NaI、Na2SO3和FeBr2各1 mol的溶液中通入足量的Cl2,将溶液在空气中加热蒸干并充分灼烧,最终得到剩余的固体物质是
A.NaCl、FeCl3、Na2SO4 B.NaCl、FeBr3、Na2SO4
C.NaCl、Fe2O3、Na2SO4 D.NaBr、FeCl3、Na2SO4
21.已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,若该溶液中只含有两种溶质,则这四种离子浓度大小顺序可能是
① c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
② c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③ c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
④ c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
A.③④ B.①③ C.②④ D.①②
22.将0.15mol/L的NaHCO3溶液与0.2mol/L的Ba(OH)2溶液等体积混合,溶液中各离子浓度从大到小的顺序正确的是
A.c(Ba2+)>c(OH-)>c(Na+)>c(CO32-) B.c(OH-)>c(Na+)>c(Ba2+)> c(CO32-)
C.c(OH-)>c(Ba2+)> c(Na+)>c(CO32-) D.c(Na+)> c(Ba2+)>c(OH-)> c(CO32-)
23.向含有等物质的量的HCl、Al2(SO4)3、NH4Cl的混合液中逐滴加入稀NaOH溶液至过量,整个过程中会发生如下四个离子反应:①Al3++3OH-=Al(OH)3↓ ②Al(OH)3+ OH-=AlO2- +2H2O ③H++ OH-=H2O ④NH4++ OH-=NH3·H2O反应的先后顺序是
A. ③④①② B.③①②④ C.③①④② D.①②③④
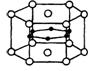 24.2001年,日本科学家发现了便于应用、可把阻抗降为零的由硼和镁两种元素组成的超导材料。这是27年来首次更新了金属超导体的记录,是目前金属化合物超导体的最高温度。该化合物也因此被美国《科学》杂志评为2001年十大科技突破之一。下图为该化合物的晶体结构单元示意图:镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内。则该化合物的化学式可表示为
24.2001年,日本科学家发现了便于应用、可把阻抗降为零的由硼和镁两种元素组成的超导材料。这是27年来首次更新了金属超导体的记录,是目前金属化合物超导体的最高温度。该化合物也因此被美国《科学》杂志评为2001年十大科技突破之一。下图为该化合物的晶体结构单元示意图:镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内。则该化合物的化学式可表示为
A.MgB B.MgB2 C.Mg2B D.Mg14B6
25.在100g浓度为18mol/L、密度为ρg/cm3 的浓硫酸中加入一定量的水稀释成9 mol/L的硫酸,则加入水的体积是
A.小于100mL B.等于100mL C.大于100mL D.等于100/ρ mL
二.填空题
26.请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个已配平的化学方程式。
□_________+□__________→□__________+□__________+□__________+□H2O
![]() 27.在一容积为2 L且容积不变的密闭容器中加入适量碳粉和x molH2O,在800℃条件下,经10s后达到如下第一次平衡:C(s)+H2O(g) CO(g)+H2(g) ; △H>0 ,此时v(H2)=0.006mol/(L.s),
c(H2O)=0.04mol/L
27.在一容积为2 L且容积不变的密闭容器中加入适量碳粉和x molH2O,在800℃条件下,经10s后达到如下第一次平衡:C(s)+H2O(g) CO(g)+H2(g) ; △H>0 ,此时v(H2)=0.006mol/(L.s),
c(H2O)=0.04mol/L
请回答下列问题:
(1)加入水的物质的量x=________
(2) 若在上述平衡混合物中加入少量CaO固体,并在此温度下达到第二次平衡,则此时CO物质的量将__________(填“增大”“减小”或“不变”)
(3)若向上述第一次平衡混合物中,再充入y molCO(y<0.12),在相同条件下达到第三次平衡,则此时H2的物质的量n的取值范围是_____________________
28.A、B、D、E是周期表中前20号元素,它们的原子序数依次增大。EA 2与水反应产生可燃性气体和白色浆状物,向该浆状物中通入AB2气体可得另一白色不溶物。B、D同主族,D的阴离子与E的阳离子具有相同的核外电子排布。请回答:
(1)已知AD2与AB2的结构相似,AD2的结构式为_________该分子是_________(填“极性分子或非极性分子”)
(2)镁条在AB2中燃烧的化学方程式为_________________________________________
(3)将D单质放入浓硝酸中加热,生成红棕色气体和一种强酸,该反应的离子方程式为_________
(4)A可形成二元弱酸H2A2O4。0.1mol H2A2O4与100mL2mol L-1的KOH溶液反应后,溶液中的离子浓度由大到小的排列顺序是_______________________________________________________
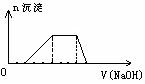 29.某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此判断:该溶液中肯定含有的阳离子是_______________________,且各离子物质的量比_____________________ 肯定不含的阳离子是_______________________
29.某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此判断:该溶液中肯定含有的阳离子是_______________________,且各离子物质的量比_____________________ 肯定不含的阳离子是_______________________
30.图表表示各物质之间的转化关系,已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液
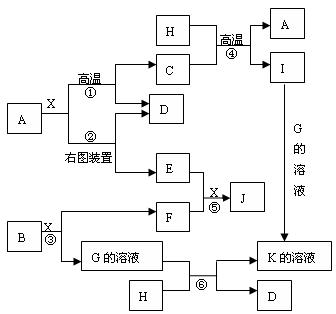
| |
| | ||||
| | ||||
请按要求填空:
(1)B的电子式______________
(2)生成E的电极反应式:__________________________反应⑤的现象是________________
(3)反应①的化学方程式_______________在实验室引发反应④的操作是___________
(4)反应⑥的离子方程式______________
三.实验题
31.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
![]() ①高温下用碳还原二氧化硅制得粗硅
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_______________________________________
_________________________
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为___________________________
_______________________
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
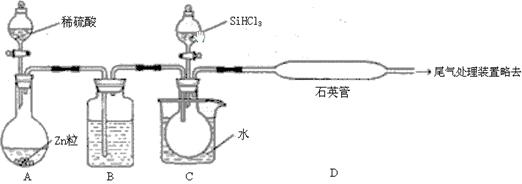
①装置B中的试剂是 。装置C中的烧瓶需要加热,其目的是_______________________
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是 。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
四.计算题
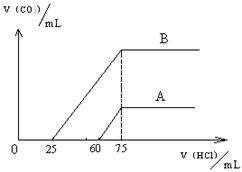 32.取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
32.取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
(1)曲线A表明,原溶液中通入CO2后,
所得溶液中的溶质为(写化学式) ___ ,
两种溶质的物质的量之比为 ;
加盐酸后产生CO2体积的最大值为 mL。
(2)曲线B表明,原溶液中通入CO2后,
所得溶液中的溶质为(写化学式) ____ ,
两种溶质物质的量之比为 ;
加盐酸后产生CO2体积最大值 mL。
(3)原NaOH溶液的物质的量浓度为__________
三、试卷讲评分析
一.选择题
1.D 2.D 3.B 4.D 5.C
6.A 7.A 8.C 9.B 10.D
11.C 12.B 13.C 14.D 15.C
16.A 17.B 18.D 19.D 20.C
21.A 22.B 23.C 24.B 25.A
二.填空题
26.24FeSO4+3OHNO3==8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O
27.(1)0.2mol
(2)减少
(3)0.12-y<n<0.12
28.(1)S=C=S 非极性分子
|
![]()
![]() (2)2Mg+CO2
2MgO+C
(2)2Mg+CO2
2MgO+C
|
![]()
![]() (3)S+4H++6NO3- 6NO2↑+SO42-+2H2O
(3)S+4H++6NO3- 6NO2↑+SO42-+2H2O
(4)C(K+)>C(C2O42-)>C(OH-)>C(HC2O4-)>C(H+)
29.H+、Al3+、NH4+,2:1:3,Mg2+、Fe3+
30.(1)
(2)Fe-2e-+2OH-=Fe(OH)2↓,白色沉淀迅速变灰绿色,最终变红褐色
|
![]()
![]() (3)3Fe+4H2O Fe3O4+4H2↑,混合物上加少量KClO3,并在中间插一镁条,点燃镁条
(3)3Fe+4H2O Fe3O4+4H2↑,混合物上加少量KClO3,并在中间插一镁条,点燃镁条
(4)2Al+2OH-+2H2O=2AlO2-+3H2↑
|
![]()
![]() 31.(1)2C+SiO2 2CO↑+Si
31.(1)2C+SiO2 2CO↑+Si
(2)蒸馏或分馏
(3)①浓H2SO4,使滴入烧瓶中的SiHCl3气化
②有固体生成,在反应温度下普通玻璃会软化,
|
![]()
![]() SiHCl3+H2
Si+3HCl
SiHCl3+H2
Si+3HCl
③排尽装置中的空气
④b、d
四.计算题
32.(1)NaOH、Na2CO3,3:1,33.6mL
(2)Na2CO3、NaHCO3,1:1,112mL
(3)0.75mol/L