年级:高三 科目:化学 教师:刘艳琴
高三年级第三次月考化学试卷
请将选择题的正确答案填涂在机读卡上。
有关相对原子质量:H: 1 C:12 O:16 Ag:108 Fe:56 S:32 Cu:64 Cl:35.5
一.选择题(本题包括25小题,每小题2分,共50 分。每小题只有一个选项符合题意)
1.下列说法正确的是
A.废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源
B.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
C.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
D.凡含有食品添加剂的食物对人体健康均有害,不宜食用
2.下列物质能通过化合反应直接制得的是 ①FeCl2 ②H2SO4 ③NH4NO3 ④HCl
A.只有①②③ B.只有②③④ C.只有①③④ D.全部
3.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内
装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确
的是
| ① | ② | ③ |
| |
| A | 黄绿色 | 橙色 | 蓝色 | 白色 |
| B | 无色 | 橙色 | 紫色 | 白色 |
| C | 黄绿色 | 橙色 | 蓝色 | 无色 |
| D | 黄绿色 | 无色 | 紫色 | 白色 |
4.下列物质中,其水溶液能导电,溶于水时化学键被破坏,且该物质属于非电解质的是
A.CO2 B.BaCO3 C.I2 D.C6H12O6(葡萄糖)
5.下列有关物质分类或归类正确的是
①混合物:盐酸、漂白粉、水玻璃、水银
②化合物:CaCl2、NaOH、HCl、HD
③纯净物:明矾、生石膏、冰醋酸、石炭酸
④同素异形体:C60、C70、金刚石、石墨
⑤同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑥同分异构体:乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯
A.①③④ B. ③④ C.②③④ D.②④⑥
6.主链含5个碳原子,有甲基、乙基2个支链的烷烃有
A.2种 B.3种 C.4种 D.5种
7.1962年,英国青年化学家以巴特莱特将PtF6 和Xe按等物质的量在室温下混合后,首次得到含有化学键的稀有气体化合物六氟合铂酸氙:Xe + PtF6 = XePtF6 有关此反应的叙述中,正确的是
A.Xe是氧化剂 B.PtF6是氧化剂
C.PtF6是氧化剂又是还原剂 D.该反应不属于氧化还原反应
8.下列关于“过氧化氢”的说法正确的是
A.过氧化氢具有杀菌消毒作用,是强酸 B.过氧化氢是离子化合物
C.过氧化氢可以发生分解反应 D.过氧化氢是水的同分异构体
9.下列叙述不正确的是
A.用酒精清洗沾到皮肤上的苯酚
B.用冷凝的方法从氨气、氮气和氢气混合气中分离出氨
C.用盐析的方法分离油脂皂化反应的产物
D.用氨水清洗试管壁附着的银镜
10.25℃,甲、乙两瓶醋酸溶液的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶醋酸溶液c(H+)之比
A.等于10 B.大于10 C.小于10 D.无法判断
![]() 11.高温下2HBr(g) H2(g)+Br2(g); △H>0,达到平衡时,要使混合气体颜色加深,可采取的方法
11.高温下2HBr(g) H2(g)+Br2(g); △H>0,达到平衡时,要使混合气体颜色加深,可采取的方法
A.降低温度 B.缩小体积 C.减小压强 D. 增大H2浓度
![]() 12.在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度不可能是
12.在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度不可能是
A.Z为0.3mol/L B.Y2为0.35mol/L C.X2为0.15mol/L D.Z为0.4mol/L
13.下列事实不能用电化学知识解释的是
A.轮船水线下船壳上装有一定数量的锌块
B.纯锌与稀硫酸反应时,滴入少量的硫酸铜后速率加快
C.铝片不用特殊方法保存
D.镀锌铁比镀锡铁耐用
14.用已知物质的量浓度的NaOH溶液测定未知物质的量浓度的盐酸,无论是酸往碱中滴还是碱往酸中滴,在其它操作均正确规范的前提下,下列操作一定会使测定结果偏高的是
A.锥形瓶未用酸液或碱液润洗 B.酸式滴定管未用待测盐酸润洗
C.碱式滴定管未用标准碱液润洗 D.滴定前仰视读数,滴定后俯视读数
15.将pH为5的硫酸溶液稀释500倍,稀释后溶液中c(SO42-):c(H+)约为
A.1:1 B.1:2 C.1:10 D.10:1
16.下列离子方程式不正确的是
A.苯酚钠溶液中加入氯化铝溶液:3C6H5O-+Al3++3H2O=Al(OH)3↓+3 C6H5OH
B.氯化银溶于氨水中:AgCl+2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O
C.重铬酸钾溶液和过氧化氢溶液:Cr2O72-+3H2O2+8H+=2Cr3++3O2↑+7H2O
D.漂白粉溶液中通SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
17.将ag Fe、Mg合金完全溶解在一定量的稀硝酸中后,收集到标准状况下的NO气体bL(设HNO3的还原产物只有NO)。再向反应后的溶液中加入足量NaOH溶液,得到沉淀物。若用守恒法求沉淀的质量,用到的守恒关系依次是
A.质量守恒、电子守恒、电荷守恒 B.电子守恒、质量守恒、电荷守恒
C.电子守恒、电荷守恒、质量守恒 D.电荷守恒、质量守恒、电子守恒
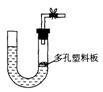 18.右图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是
18.右图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是
A.大理石和稀硫酸制取二氧化碳 B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气 D.电石和水制取乙炔
![]() 19.镍--镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,放电时的电极反应是:Cd+2OH--2e-=Cd(OH)2,2NiO(OH)+2H2O+2e-
=2Ni(OH)2+2OH-,下列说法不正确的是
19.镍--镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,放电时的电极反应是:Cd+2OH--2e-=Cd(OH)2,2NiO(OH)+2H2O+2e-
=2Ni(OH)2+2OH-,下列说法不正确的是
A.电池的总反应式是Cd+2NiO(OH)+2H2O 2Ni(OH)2+ Cd(OH)2
B.电池充电时,镉元素被氧化
C.电池放电时,电池负极周围溶液的PH不断减小
D.电池充电时,电池负极和电源的负极相连
20.已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
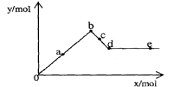 A.a~b时沉淀的物质的量:A1(OH)3比BaSO4多
A.a~b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c~d时溶液中离子的物质的量:AlO2-比Ba2+少
C.a~d时沉淀的物质的量: BaSO4可能小于A1(OH)3
D.d~e时溶液中离子的物质的量:Ba2+可能等于OH-
21.胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法:①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面;③它的部分同分异构体能发生银镜反应;④1mol该化合物最多可与2mol Br2发生反应。其中正确的是
A.①③ B.①②④ C.②③ D.②③④
22.下列说法中不正确的是:
①质子数相同的粒子一定属于同种元素;
②同位素的性质几乎完全相同;
③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;
④电子数相同的粒子不一定是同一种元素;⑤一种元素只能有一种质量数;
⑥某种元素的相对原子质量取整数,就是其质量数。
A.①②④⑤ B.③④⑤⑥ C.②③⑤⑥ D.①②⑤⑥
23.下列关于晶体的说法一定正确的是
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+与12个O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
![]() 24.16mL由NO与NH3组成的混合气体在催化剂作用下于400℃左右可发生反应
24.16mL由NO与NH3组成的混合气体在催化剂作用下于400℃左右可发生反应
6NO+4NH3 5N2+6H2O(g),达平衡后在相同条件下混合气体的体积变为17mL。原混合气体中NO与NH3的物质的量之比可能是①3:1 ②3:2 ③3:4 ④3:5
A.①② B.①④ C.②③ D.③④
25.用物质的量都是0.01mol的HCN和NaCN配成1L混合溶液,已知其中c(CN-)<c(Na+),对该溶液的下列判断不正确的是
A.c(HCN)-c(CN-)=c(OH-) B.c(OH-)>c(H+)
C.c(HCN) > c(CN-) D.c(HCN)+c(CN-)=0.02 mol/L
二.填空题
26.在周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质与它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此回答:
(1)铍能否与冷水反应放出H2?______________
(2) 铍的最高价氧化物对应的水化物是_________________(填“酸”、“碱”或“两性氢氧化物”),证明这一结论的有关离子方程式为____________________________________________________
27.某二元酸(H2B)在水中的电离方程式是:H2B=H++HB- HB-![]() H++B2-
H++B2-
回答下列问题:
(1)Na2B溶液显________(填“酸性”、“中性”、“碱性”),
理由____________________________________________________ (用离子方程式表示)
(2)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是____________
A. c(B2-)+c(HB-)+c(H2B)=0.1mol/L B. c(Na+)+c(OH-)=c(H+)+c(HB-)
C. c(Na+)+c(H+) = c(OH-) + c(HB-)+2c(B2‑) D. c(Na+) =2c(B2‑)+ 2c(HB-)
(3)已知0.1mol/LNaHB溶液的pH=2,则0.1mol/LH2B溶液中氢离子的物质的量浓度可能是______0.11mol/L(填“>”、“<”“=”)
(4) 0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是_________________________________
28.如图所示:当关闭K时,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
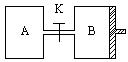 2X(g)+2Y(g)
2X(g)+2Y(g) ![]() Z(g)+2W(g); △H<0,达到平衡(Ⅰ)时,V(B)=0.8aL。
Z(g)+2W(g); △H<0,达到平衡(Ⅰ)时,V(B)=0.8aL。
请回答:
(1)B中X的转化率为:____________
(2)A中W和B中Z的物质的量比较:n(W)A________n(Z)B(填“>、<、 =”)
(3)打开K,过一段时间重新达到平衡(Ⅱ)时,B的体积为____________(用含a的代数式表示,连通管中气体体积不计)。
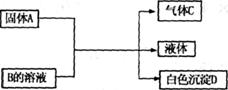
29.A、B、C、D均为中学化学常见的物质,它们间的反应关系如下图所示。
(1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸。
有关反应的化学方程式为 _______
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液。
①A是NaHCO3时,该反应的离子方程式为: _______________
②A是一种淡黄色固体,且A与B以物质的量之比为2:1相混合时,推知B的化学式为
(3)若A是碳化钙(CaC2),A与B的溶液反应时只生成气体C、CaCO3和水;C的燃烧热为1300kJ·mol-1,
C燃烧的热化学方程式为 _____________________________
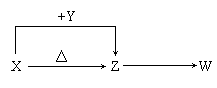 30.X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
30.X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
请回答:
(1)W的电子式是________________________________。
(2)X与Y在溶液中反应的离子方程式是______________________________。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置III中产生白色沉淀,装置V中可收集到一种无色气体。
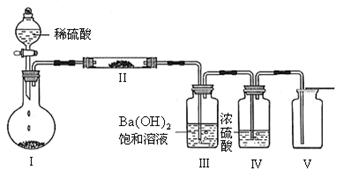
①装置II中物质的化学式是_____________________。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置V中气体,该化合物的化学式是_______________,所需仪器装置是_____________(从上图选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是_______________________________________。
31.2005年的诺贝尔化学奖颁给了3位在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解反应实际上是在金属烯烃络合物的催化下实现C=C双键两边基团换位的反应。如下图表示了两个丙烯分子进行烯烃换位,生成两个新的烯烃分子——丁烯和乙烯。
![]()

又知:2CH2=CH2+O2 2CH3CHO
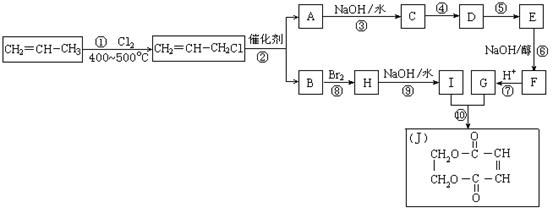
现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I和G在不同条件下反应可生成多种化工产品,如环酯J。
请按要求填空:
(1)写出下列反应的反应类型:
①:______________,⑥:______________,⑧:______________。
(2)D中所含官能团的名称:
(3)反应②的化学方程式是___________________________________________。
(4)反应④、⑤中有一反应是与HCl加成,该反应是________(填反应编号),
物质E的结构简式是________________。
(5)反应⑥的化学方程式是
(6)反应⑩的化学方程式是___________________________________________。
三.实验题
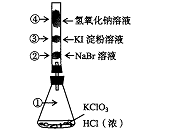
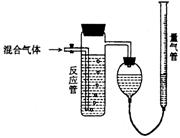 32.工业上测量SO2、N2、O2混合气体中SO2含量的装置如右图:
32.工业上测量SO2、N2、O2混合气体中SO2含量的装置如右图:
反应管中装有碘的淀粉溶液。SO2和I2发生的反应为:
SO2+I2+2H2O=H2SO4+2HI
(1)混合气体进入反应管后,
量气管内增加的水的体积等于___________的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气,
则测得的SO2含量 (选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用_____________代替(填写物质名称)。
(4)若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为:________________________
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为 (选下列仪器的编号)。a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
四.计算题
33.有FeCl3和CuCl2的混合液400mL,其中c(Cl-)=a mol·L-1。在溶液中加入过量铁粉b g,充分
反应后过滤,滤渣经洗涤、干燥后,称得质量为c g。
(1)若b=c时,原溶液中c(FeCl3)= ______________,c(CuCl2)= ______________;充分反应后滤
液中c(Fe2+)=______________(用a表示)。(忽略溶液的体积变化)
(2)若b值不变,c的数值越大,说明混合液中CuCl2的质量分数越___________(填“大”或“小”),
c的最大值应小于______________。(用含a、b的关系式表示)
三、试卷讲评分析
一.选择题
1.A 2.D 3.A 4.A 5.B 6.A
7.B 8.C 9.D 10.C 11.B 12.D
13.C 14.C 15.C 16.D 17.C 18.B
19.B 20.D 21.C 22.D 23.B 24.C
25.A
分析:
5.①中水银为单质汞,②中HD为同种元素组成的物质属单质,⑤中除CH2O2为甲酸外,其它分子组成即可是羧酸,又可是酯,不一定是同系物。⑥中物质分子组成有差异,不是同分异构体。
10.当两瓶醋酸分子浓度为10:1时,由于电离程度的不同,c(H+)不是10:1,溶液越稀电离程度越大,所以c(H+)之比小于10。
15.pH=5的稀H2SO4溶液,c(SO42-)=5×10-6mol/L c(H+)=1×10-5mol/L,稀释500倍后,c(SO42-)=1×10-8mol/L,而c(H+)接近10-7mol/L(酸溶液无限稀释接近中性)
16.亚硫酸盐有强还原性,HClO有强氧化性,应发生氧化还原反应,D项原理错误。
24.此反应为可逆反应,可逆反应不能进行到底,根据反应方程式当混合气体体积增大1ml时,反应的NO和NH3分别为6ml和4ml,但混合气体中的NO,NH3必需分别大于6ml和4ml。
二.填空题
26.(1)不能(2)两性氢氧化物
Be(OH)2+2H+=Be2++2H2O, Be(OH)2+2OH-=BeO22-+2H2O
27.(1)碱性,B2-水解,B2-+H2O![]() HB-+OH-
HB-+OH-
(2)C,D
(3)<
(4)c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)
28.(1)80% (2)<(3)0.2aL
29.(1)(NH4)2SO4+Ba(OH)2=BaSO4↓+2H2O+2NH3↑
(2)①3HCO3-+Al3+=Al(OH)3↓+3CO2↑
②Al2(SO4)3
(3)2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H= -2600kJ/mol
30.(1)
(2)HCO3-+OH-=CO32-+H2O
(3)①Na2O2 ②H2O2,I、IV、V
(4)2Na2CO3+Cl2+H2O=2NaHCO3+NaClO+NaCl
31.(1)①取代反应⑥消去反应⑧加成反应
(2)羟基、氯原子(或卤原子)
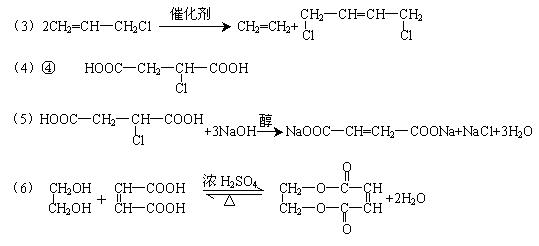 |
三.实验题
32.(1)N2、O2
(2)偏低
(3)酸性KMnO4溶液或溴水
(4)![]()
(5)b c e g或b e g或c e g
33.(1)0.1a mol/L,0.35a mol/L,0.5a mol/L
(2)大,b+1.6a
 ④
④