高三年级第一次月考化学学科检测试卷
第I卷(共40分)
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 S-32 Cl-35.5 K-39 Cu-64 I--127
一、选择题 每小题2分,只有一个正确选项,填入后面的方框中
1.下列各项中表达正确的是( )
A.F—的结构示意图:![]() B.CO2的分子模型示意图:
B.CO2的分子模型示意图:![]()
C.NaCl的电子式:![]() D.N2的结构式: :N≡N:
D.N2的结构式: :N≡N:
2. 下列叙述正确的是( )
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.有单质参加或生成的反应一定属于氧化还原反应
C.失电子难的原子,获得电子的能力一定强
D.元素由化合态变成游离态时,它可能被氧化,也可能被还原
3.下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个离子方程式表示的是( )
A.稀盐酸 Na2CO3溶液 B.稀H2SO4溶液 NaAlO2溶液
C.Cu FeCl3溶液 D.浓氨水 AgNO3溶液
4.向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是( )
A.碳酸氢钠溶液中滴加稀盐酸 B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液 D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
5.X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D. Y的单质能将X从NaX的溶液中置换出来
6.下列物质属于原子晶体的化合物是( )。
A、金刚石 B、水晶 C、刚玉 D、干冰
7.氯化铁溶液和氢氧化铁胶体具有的共同性质是( )
A、分散质直径都在1nm~100nm之间
B、能透过半透膜
C、呈红褐色
D、加热蒸干并灼烧后都有氧化铁生成
8.下列说法中正确的是(NA表示阿伏加德罗常数的值)( )。
A、SiO2晶体中,1mol硅原子与氧原子形成的共价键数是2NA
B、标准状况下,1L己烷所含碳原子个数约为6NA/22.4
C、3.2g铜在硫蒸气中完全燃烧,转移的电子数为0.1NA
D、常温常压下,0.1mol氖气含有的电子数为1NA
9.对于下列事实的解释错误的是( )。
A、常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C、在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
D、反应CuSO4+H2S==CuS↓+H2SO4能进行,说明硫化铜既不溶于水也不溶于稀硫酸
10.一定条件下反应:A2(气)+B2(气) ![]() 2AB(气)达到化学平衡状态的标志是(
)
2AB(气)达到化学平衡状态的标志是(
)
A、单位时间内生成n mol A,同时消耗2n mol AB
B、容器内压强不随时间变化而变化
C、混合气体密度不随时间变化而变化
D、单位时间内生成2n mol AB,同时生成n mol B
11.下列离子方程式中正确的是( )
A.硫化亚铁放入盐酸中 S2- + 2 H+ = H2S ↑
B.硫酸铜溶液中通入硫化氢 Cu2+ + H2S = CuS↓+ 2 H+
C.氯化铝溶液中加入过量氨水 Al3+ + 4NH3•H2O = AlO2- + 4NH4+ +2H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3- + OH- = CO32- + H2O
12.在含有![]() 且能使酚酞变红的无色溶液中,可大量存在的离子组是( ).
且能使酚酞变红的无色溶液中,可大量存在的离子组是( ).
A.![]() 、
、![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]() 、
、![]()
13.由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生Cl2。下列关于混盐CaOCl2的有关判断不正确的是( )
A.该混盐与硫酸反应产生1molCl2时转移2NA个电子
B.该混盐的水溶液呈碱性
C.该混盐具有较强的氧化性
D.该混盐中的氯元素的化合价为+1和-1
14.化学反应可视为旧健断裂和新键形成的过
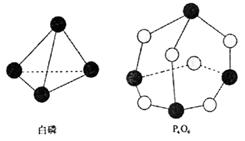 程,化学键的键能是形成(或拆开)1mol
程,化学键的键能是形成(或拆开)1mol
化学键时释放(或吸收)出的能量。已知
白磷和P4O6的分子结构如右图所示,现提
供以下化学键的键能(kJ·mol-1)P—P:
198 P—O:360 O—O:498则反应P4
(白磷)+3O2→P4O6的反应热△H为( )
A.-1638kJ/mol B.+1638kJ/mol C.-126kJ/mol D.+126kJ/mol
15.2001年报道镁和硼形成的化合物刷新了金属化合物超导温度的最高记录。
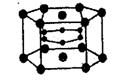 如图示意的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱内。则该化合物的化学式可表示为( )
如图示意的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱内。则该化合物的化学式可表示为( )
A.MgB2 B.MgB C.Mg2B D.Mg3B2
16.在一定条件下,CO和CH4燃烧的热化学方程式分别为 ( )
2CO(g)+O2(g)=2CO2(g);△H=-566KJ/mol
CH4(g)+2O2(g)=2CO2(g)+2H2O(l);△H=-890KJ/mol
由等物质的量的CO和CH4的混合气体共4mol,在上述条件下完全燃烧时释放的热量为( )
A.1173KJ B.1456KJ C.2346KJ D.1780KJ
17.下列各组气体或溶液用括号内试剂加以鉴别,其中不合理的是( )
A.二氧化碳、二氧化硫、一氧化碳(品红溶液)
B.氯化钠、硝酸银、碳酸钠(稀盐酸)
C.酒精、醋酸、醋酸钠(石蕊试液)
D.硫酸、硝酸钡、氯化钾(碳酸钠溶液)
18.下列离子方程式表示错误的是( )
A、等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:
HCO3-+Ba2++OH-===BaCO3↓+H2O
B、Fe2O3溶于过量氢碘酸溶液中:
Fe2O3+6H++2I-===2Fe2++3H2O
C、铜片加入稀硝酸中:
3Cu+2NO3-+8H+===3Cu2++2NO↑+4H2O
D、三氯化铁浓溶液滴入沸水中,制取氢氧化铁胶体:
Fe3++3H2O=Fe(OH)3↓+3H+
19.已知:I-、 Fe2+、SO2、Cl- 和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl- < Fe2+< H2O2<I-<SO2 则下列反应不能发生的是( )
A. 2Fe3+ + SO2 + 2H2O=2Fe2+ + SO42- + 4H+
B. I2 + SO2 + 2H2O=H2SO4 + 2HI
C. H2O2 +H2SO4=SO2 + O2 + 2H2O
D. 2Fe3+ + 2I-=2Fe2+ + I2
20.多硫化钠Na2Sx(X≥2)在结构上与Na2O2,FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原为NaCl反应中,Na2Sx与NaClO的物质的量之比为1:16,则X值是 ( )
A、5 B、4 C、3 D、2
第Ⅱ卷(共60分)
二简答题
21.(6分)已知下列变化过程中,有0.2molRxO42—离子参加反应,共转移0.4mol电子。RxO42— + MnO4—+ H+ → RO2 + Mn2+ + H2O
(1)X值为____________________。
(2)参加反应的氢离子的物质的量为____________mol。
22.(12分)(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应
的离子方程式:_____________________________________。
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:
____________________________________________________。
(3)明矾溶液与少量氢氧化钡溶液反应,请写出此步反应的离子方程式:
(4)硫酸铵与氢氧化钡溶液反应,请写出此步反应的离子方程式:
23.(6分)配平氧化还原反应方程式,标出电子转移的方向和数目。
(1) NH3 + NO2 → N2 + H2O
(2)氧化产物与还原产物的质量比为 。
24.(11分)W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。W原子最外层电子数不超过最内层电子数。X原子L层电子数是其它各层电子总数的2倍。Y原子形成的气态氢化物分子与形成的最高价氧化物分子的电子数之比为5 :11。Z是自然界中含量最多的元素。
⑴Y和Z形成的化合物与W和Z形成的化合物反应,其化学方程式可能是:
。
(2)Y元素可形成化学式为Y60的物质,该物质称为足球烯。已知该物质溶于苯等有机溶剂,熔点较低,由此可推测Y60晶体属于 晶体,Y原子间形成 键。
(3)W、X元素的最高价氧化物对应水化物的碱性强弱为 <
(4)这四种元素原子半径的大小为 > > >
(⑶、⑷填化学式和元素符号)
![]() 25.(6分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式
,若1克水蒸气转化成液态水放热2.444kJ,则反应H2(g)+
25.(6分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式
,若1克水蒸气转化成液态水放热2.444kJ,则反应H2(g)+![]() O2(g)=H2O(l)的
O2(g)=H2O(l)的![]() H=
KJ.mol-1,氢气的燃烧热为
H=
KJ.mol-1,氢气的燃烧热为
-----------------------KJ.mol-1
26.(6分)利用图1所示装置收集以下8种气体(图中试管的位置不得变化):
|
|
![]() a.H2,b.Cl2,c.CH4,d.HCl, e.NH3,f.NO, g.H2S,h.SO2
a.H2,b.Cl2,c.CH4,d.HCl, e.NH3,f.NO, g.H2S,h.SO2
(1)若试管是干燥的,则由B口进气可收集的气体有
(写序号下同)。
(2)若试管充满水,可收集的气体有 ,这时气体由 口进入。
(3)若试管是干燥的,则A口进气,可收集的气体有 。
(4)若在试管内装入浓硫酸进行气体干燥,则可用此装置来干燥的气体有 ,这时气体由 口进入。
三计算题:
27.(6分)将H2S跟浓HNO3溶液反应,当HNO3过量时,H2S的氧化产物是H2SO4,反应物HNO3的还原产物是NO,生成物中还有水,写出这一反应的化学方程式 。
如反应中有2.4mol电子转移时,生成的NO在标准状况下的体积是 L,这些NO全部被氧化为NO2,需O2的体积为 L(标准状况)。
28.(7分)为了预防碘缺乏病,国家规定每千克食盐中应含有40~50毫克的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:
IO3—+5I—+6H+=3I2+3H2O
I2+2S2O32—=2I—+S4O62—
答 案
一 选择题(40分)
| 1--10 | A | D | C | A | C | B | D | D | A | D |
| 11--20 | B | D | A | A | A | C | A | D | C | A |
二 简答题
21(6分)(1)X值为 2 ,(2) 0.64
22 (12分)(1) 2H+ + SO42- + 2OH- + Ba2+= 2H2O + BaSO4↓
(2) SO42 + Ba2+= BaSO4↓
(3) 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4 ↓
(4) 2NH4++SO42-+Ba2++2OH-=2NH3·H2O+BaSO4 ↓
23(6分)(1) 6 NH3 + 8 NO2 → 7 N2 + 6 H2O
(2)氧化产物与还原产物的质量比为 3:4 。
24(11分)(1)化学方程式可能是:
Na2O+CO2=Na2CO3 2Na2O2+2CO2=2Na2CO3+O2 。
(2)Y60晶体属于 分子 晶体,Y原子间形成 共价 键。
(3)W、X元素的最高价氧化物对应水化物的碱性强弱为 Mg(OH)2 < NaOH
(4)这四种元素原子半径的大小为 Na > Mg > C > O
25(6分)2H2(g)+O2(g)=2H2O(g)+2H2O(l);△H=-483.6KJ/mol
-285.8 , 285.8 。
26(6分)(1) a c e (2) a c f B (3) bdh (4) abcdfh A
三计算
27(6分) 3H2S+8HNO3=3H2SO4+8NO+4H2O , 17.92 , 8.96 。
28(7分)通过计算该食盐每千克中含碘酸钾45mg,合格