高三年级调研考试化学试卷
(时间:100分钟;满分100分)
相对原子质量:H—1 C—12 N—14 O—16 Na—23 S—32 Fe—56
Cu—64 Ag—108
一、选择题(每小题3分,共48分,每小题只有一个正确选项)
1.氮化硅(Si3N4)是一种新型的耐高温、耐磨材料,在工业上有广泛的用途,它属于( )
A.原子晶体 B.分子晶体 C.离子晶体 D.金属晶体
2.在下列有关晶体的叙述中错误的是 ( )
A.离子晶体中,一定存在离子键 B.原子晶体中,只存在共价键
C.金属晶体的熔、沸点的均很高 D.稀有气体的原子能形成分子晶体
3.氯化铁溶液与氢氧化铁胶体具有的共同性质是 ( )
A.分散质颗粒直径都在1nm—100nm之间
B.能透过半透膜
C.呈红褐色
D.加热蒸干灼烧后都有氧化铁生成
4.下列分散系不属于胶体的是 ( )
A.淀粉溶液 B.KMnO4溶液 C.有色玻璃 D.血液
5.已知常温下,在溶液中可发生如下两个离子反应 ( )
Ge4++Fe2+=====Fe3++Ge3+ Sn2++2Fe3+====2Fe2++Sn4+
由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是 ( )
A.Sn2+、Fe2+、Ge3+ B.Sn2+、Ge3+、Fe2+
C.Ge3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ge3+
6.下列反应的离子方程式中正确的是 ( )
A.氯化亚铁溶液中通入氯气:Fe2++Cl2====Fe3++2Cl-
B.AlCl3溶液中加入过量氨水:Al3++4OH-====AlO2-+2H2O
C.饱和石灰水跟稀硝酸反应:Ca(OH)2+2H+====Ca2++2H2O
D.烧碱溶液中通入过理的CO2:OH-+CO2====HCO3-
7.1.5g火箭燃料二甲基肼(CH3—NH—NH—CH3)完全燃烧,放出热量50kJ,则二甲基肼
的燃烧热为 ( )
A.2000kJ B.2000kJ/mol C.3000kJ D.1500kJ/mol
8.用惰性电极电解下列物质溶液,电解一段时间后,再加入一定量的另一种纯净物(括号
内),能使溶液恢复原来成分和浓度的是 ( )
A.NaCl(NaCl) B.NaOH(NaOH) C.CuSO4(CuO) D.CuCl2(HCl)
9.用质量均为100g的铜棒作电极,电解足量的硝酸银溶液,电解一段时间后,两个电极的
质量差为28g,则阴极的质量为 ( )
A.128g B.121.6g C.114g D.119g
10.工业在接触法制硫酸的生产中,采取下列措施有利于提高SO2转化率的是 ( )
①V2O5作崔化剂 ②通入过量O2 ③SO2、O2进行二次氧化 ④通入过量SO2
A.①②③ B.②③ C.②③④ D.①②③④
11.某离子晶体的晶胞结构为立方体,立方体每个顶点为A,每个棱中心为B,体心为C,则该晶体的化学式为 ( )
A.ABC B.ABC3 C.ABC2 D.AB3C
12.下列气体中不能用98.3%的浓硫酸干燥的是 ( )
A.SO3 B.SO2 C.H2 D.HCl
13.粗食盐中含有少量的Ca2+、Mg2+、SO42-离子,现采用①Na2CO3 ②Ba(OH)2 ③HCl来除去这些杂质离子,则这三种试剂添加顺序是 ( )
A.①②③ B.①③② C.②①③ D.②③①
14.某Na2SO4溶液含有少量的Fe2(SO4)3,若用该溶液制取Na2SO4·10H2O,可供选择的操作用:①加适量H2SO4溶液,②加金属钠 ③结晶 ④加过量NaOH溶液,⑤加强热灼烧, ⑥过滤。正确的操作步骤是 ( )
A.④⑥①③ B.②⑥③ C.④⑥③② D.②⑥①③⑤
15.限用一种试剂区别NaOH、Ca(OH)2、HCl、明矾四种溶液,应选用下列试剂中的( )
A.石蕊试液 B.AgNO3溶液 C.BaCl2溶液 D.小苏打溶液
16.能大量共存于同一溶液中,但当pH=0时会有气泡产生,pH=14时会有沉淀生成的离子组是 ( )
①Na+、Ba2+、Cl-、HCO3- ②K+、NH4+、SiO32-、SO42-
③Ca2+、NH4+、SO42-、SO32- ④Fe2+、Al3+、NO3-、Br-
A.① B.①③ C.②③ D.①④
二、填空题(共16分)
17.(3分)1.00L 1.00mol·L-1H2SO4溶液与2.00L 1.00mol·L-1NaOH溶液完全反应,放出114.6kJ的热量,由此可推知H2SO4和NaOH发生中和反应的中和热为
,表示该中和热的热化学方程式为
。
18.(3分)实验室制取Fe(OH)3胶体的离子方程式是 ;
证明胶体已经制好最简单的方法是 ;用 方法可以净化、精制所得的胶体。
 19.(7分)银锌电池广泛用做各种电子仪器的电源,它的充放电过程可表示为:
19.(7分)银锌电池广泛用做各种电子仪器的电源,它的充放电过程可表示为:
2Ag +Zn(OH)2 Ag2O+Zn+H2O
回答下列有关问题:
(1)电池在放电时,作负极的是 。
(2)该电池属于 性电池(填“酸”“碱”或“中”)。
(3)充电过程的反应是 (反应(填“放热”或“吸热”)。
(4)写出充电时的电极反应式:
阳极 ;
阴极 。
(5)充电时,电池的正极应接电源的 极。
(6)试简述回收该种电池的意义: 。
20.(3分)在热的稀硫酸溶液中溶解了11.4gFeSO4。当加入50mL 0.5mol·L-1KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
FeO4+KNO3+H2SO4→K2SO4+Fe2(SO4)3+NxOy+H2O
(1)推算出x= ,y= 。
(2)反应中的氧化剂为 。
三、推断题(共13分)
21.(7分)A、B、C、D四种短周期元素分别处于两个族中,两族序数之和为10,它们彼此之间能形成AD、BD2等三种化合物,以此推断这三种化合物的化学式分别是 、 、 ,晶体类型分别属于 、 、
,它们之中的 既不与碱反应,又不与酸反应。
22.(6分)有一包粉状的混合物,可能含有MgCl2、FeCl3、NaOH、CuSO4、Al2(SO4)3、KNO3、CaCO3、NaCl中的两种或多种。将混合物少量置于水中溶解,得无色透明溶液。再将所得溶液分为两份,一份中通入CO2,有白色沉淀出现,滴入稀盐酸,沉淀消失;另一份中加入BaCl2溶液,同样有白色沉淀出现,此沉淀不溶于稀硝酸。以此推断:
(1)原混合物中肯定有 ;
(2)原混合物中肯定没有 ;
(3)原混合物中,不能肯定是否含有 。
四、实验题(共17分)
23.(4分)某氯碱厂,以石灰石,食盐和水为原料制取漂白粉。请写出有关反应的化学方程式。
24.(9分)根据实验室中测定硫酸铜晶体里结晶水含量的实验,填写下列空白。
(1)从下列仪器中选出实验所需仪器(用标号字母填空) 。
A.托盘天平(磕码) B.泥三角
C.试管夹 D.酒精灯
E.蒸发皿 F.玻璃棒
G.坩埚 H.干燥器
I.石棉网 J.三脚架。
除上述仪器外,还需要的仪器是 。
(2)某学生实验后得到以下数据:
| 加热前质量 | 加热后质量 | |
| W1(容器质量) | W2(容器质量+晶体质量) | W3(容器质量+无水CuSO4质量) |
| 5.4g | 7.9g | 6.8g |
测定结晶水的质量分数计算式(用W1、W2、W3表示)为:
w(H2O)= 。
该生实验测定结果误差是 (填“偏高”或“偏低”或“不偏”。)
(3)该学生产生实验误差的原因可能是(填写字母) 。
A.加热前称量时容器未完全干燥
B.最后两次加热后的质量相差较大(大于0.1g)
C.加热后容器未放入干燥器中冷却
D.加热过程中晶体有少量溅失
25.(4分)用足量的锌粒与一定量的稀硫酸反应制取氢气,为了提高反应速率,但又不影响生成氢气的总量,在实验中可采取哪些措施(至少写出两种)?并说明理由。
五、计算题(共6分)
26.(6分)在25℃时,用铂电极电解密度为ρg/cm3的一定量的Na2SO4饱和溶液。一段时间后,阴极析出amol气体,同时溶液中析出bgNa2SO4·10H2O。如果在这一过程中温度不变,试求:
(1)此时Na2SO4溶液中溶质量分数为多少?
(2)此时Na2SO4溶液中物质的量浓度是多少?
(3)25℃时,Na2SO4的溶解度是多少?
高三年级调研考试
化学试卷参考答案
一、选择题:(每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | A | C | D | B | A | D | B | C | B | B | D | A | C | A | D | D |
二、填空题(每空1分,共16分)
17.(3分)57.3kJ/mol
![]()
![]() H2SO4(aq)+NaOH(aq)====
H2SO4(aq)+NaOH(aq)==== ![]() Na2SO4(aq)+H2O(1); △H=-57.3kJ/mol
Na2SO4(aq)+H2O(1); △H=-57.3kJ/mol
18.(3分)Fe3++3H2O Fe(OH)3(胶体)+3H+;丁达尔现象;渗析
19.(7分)(1)Zn (2)碱 (3)吸热
(4)阳极:2Ag+2OH--2e-====Ag2O+H2O
阴极:Zn(OH)2+2e-====Zn+2OH-
(5)正
(6)要减少重金属Ag+对环境的污染,又可将Ag回收利用。
20.(3分)(1)1,1 (2)KNO3
三、推断题(共13分)
21.(7分)CO、SiO2、SO3,分子晶体、原子晶体、分子晶体,CO(每空1分)
22.(6分)(1)NaOH、Al2(SO4)3
(2)CuSO4、CaCO3、FeCl3、MgCl2
(3)NaCl、KNO3(每空2分)
四、实验题(共17分)
23.(4分)(1)2NaCl+2H2O 电解 2NaOH+H2↑+Cl2↑
(2)CaCO3 △ CaO +CO2
(3)CaO+H2O=====Ca(OH)2
(4)2Ca(OH)2+2Cl2====CaCl2+Ca(ClO)2+2H2O
24.(9分)(1)ABDFGHJ (2分)研钵、坩钳、药匙(3分)
(2)![]() (2分) 偏高(1分)
(2分) 偏高(1分)
(3)AD(1分)
25.(4分)措施一:给反应液(或稀硫酸)加热。因为其它条件不变,升高温度,可以提高反应的速率。
措施二:给稀硫酸中加入少量CuSO4。因为锌可以和溶液中的CuSO4反应置换出Cu来,锌与铜在稀硫酸中构成无数个微小锌一铜原电池,能加快反应的速率。
五、计算题(共6分)
26.(6分)解:(1)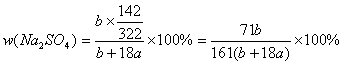 (2分)
(2分)
(2)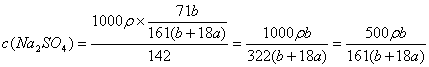 (mol·L-1)(2分)
(mol·L-1)(2分)
(3)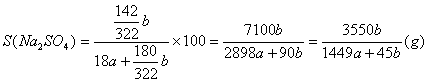 (2分)
(2分)
答:(略)。