高三一学部化学周检测三
一、选择题(本题包括22小题,每小题4分,共88分。每小题只有一个选项符合题意) 制作:chemstar
1.某学生做完实验以后,采用以下方法分别清洗所用仪器:⑴用稀硝酸清洗做过银镜反应的试管。⑵用酒精清洗做过碘升华的烧杯。⑶用浓盐酸清洗做过高锰酸钾分解实验的试管。⑷用盐酸清洗长期存放过三氯化铁溶液的试剂瓶。⑸用氢氧化钠溶液清洗盛过苯酚的试管。你认为他的操作:
A.⑵不对 B.⑶、⑷不对 C.⑷、⑸不对 D.全部正确
2.将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是
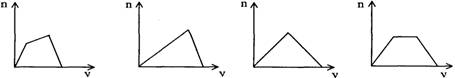
A B C D
3.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A. 向碳酸氢镁溶液中加人过量氢氧化钠 Mg2++HCO3-+OH-→MgCO3↓+H2O
B. 硫氢化钠的水解:HS-+H2O![]() H3O++S2-
H3O++S2-
C. 少量氢氧化钙溶液与碳酸氢钙溶液混合:Ca2++HCO3-+OH-→CaCO3↓+H2O
D. 表示氢气燃烧热的热化学方程式:2 H2(g)+ O2(g)=2 H2O(g);ΔH = -571KJ/mol
4.下列各组试剂在溶液中反应,当两种试剂的量发生改变时,不能用同一离子方程式边式的是 A.氯化镁、氢氧化钠 B.硫酸钠、氢氧化钡
C.氯化铝、氨水 D.溴化亚铁、氯水
5.氯胺是长效缓释有机氯消毒剂,其杀菌能是一般含氯消毒剂的4-5倍,有关氯胺(NH2Cl)的说法不正确的是
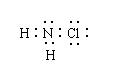 A、氯胺在水中水解产物最初产物为NH2OH(羟氨)和HCl
A、氯胺在水中水解产物最初产物为NH2OH(羟氨)和HCl
B、氯胺的电子式(见右)为:
C、氯胺的消毒原理与漂白粉相似
D、氯胺与浓盐酸混合可产生氯气
6.下列有关化学实验的操作或说法中,正确的是( )
A.用有少量蒸馏水的锥形瓶装待测液进行中和滴定实验,使测定结果偏低
B.在进行硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行4次
C.苯酚中滴加少量稀溴水出现三溴苯酚白色沉淀
D.检验溴乙烷中的溴元素时,将溴乙烷和氢氧化钠溶液混合加热后,需加硫酸酸化
7.世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用。ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
A.1︰1 B.2︰1 C.1︰2 D.2︰3
8.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羧基硫(COS),已知羧基硫分子中所有原子均满足八电子结构,结合周期表知识,有关说法正确的是
A、羰基硫属于非极性分子 B、羰基硫沸点比CO2低
C、羰基硫的电子式为:D、羰基硫分子中三个原子不可能共线
9.美国“9.11”恐怖事件给纽约带来一场严重的环境灾难——石棉污染,易使吸入石棉纤维者患肺病。已知石棉是硅酸盐矿物,某种石棉的化学式可表示为:Ca2MgxSiyO22(OH)2,式中x、y的值分别为
A、8,3 B、5,8 C、3,8 D、8,5
10. “耐高温长寿命抗氧化陶瓷基复合材料应用技术”获2004年度国家技术发明奖一等奖。该复合材料的强度比钢还大,在航空航天器中用来替代金属材料,可节约20~30%的燃料。下列关于该材料的叙述中不正确的是
A.该材料属于新型无机非金属材料 B.该材料的化学性质非常稳定
C.与金属一样有较好的传热性能 D.可以替代金属做耐高温结构材料
11.下列离子在溶液中因发生氧化还原反应而不能大量共存的是
A. H3O+、NO3-、Fe2+、Na+ B. Ag+、NO3-、Cl-、K+
C. K+、Ba2+、OH-、SO42- D. Cu2+、NH4+、Br-、OH-
12.下列离子方程式书写不正确的是
![]() A. 碳酸钠溶液中加入过量的苯酚
+
A. 碳酸钠溶液中加入过量的苯酚
+![]() ®
+
®
+![]()
B. 次氯酸钙溶液中通入过量的二氧化碳ClO- +CO2+H2O ® ![]() +HClO
+HClO
C.NH4HCO3溶液与足量NaOH溶液混合 NH4++HCO3-+2OH-====NH3·H2O+ CO32-+ H2O
D.明矾溶液中加入过量的Ba(OH)2溶液:
2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
13.某盐酸的浓度为12.0 mol·L-1,其密度为1.19 g·cm-3。现有该浓度的盐酸100 m3,则用于吸收HCl形成该盐酸的水的体积是
A.75.2 m3 B.85.5 m3 C.90.8 m3 D.100 m3
14.甲、乙两同学各取相同的硝酸钾溶液90g,甲将溶液蒸发20g水后再冷却到20℃,析出晶体4g;乙将溶液蒸发25g水后也冷却到20℃,析出晶体5.6g,原硝酸钾溶液中溶质的质量分数 A.32% B.24.2% C.22.2% D.16.7%
15. 无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )
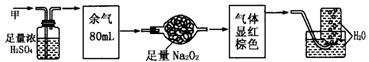
A.NH3、NO2、N2 B. NH3、NO、CO2 C.NH3、NO2、CO2 D.NO、CO2、N2
16.钠盐和钾盐性质相似,但在实际生产中多用钾盐而不用钠盐。如在实验室制氧气是用 KClO3而不是用NaClO3,制黑火药用KNO3而不用 NaNO3,并且在KNO3中不能含有NaNO3,对此现象,以下各种理由合理的是
A.钠盐比钾盐更容易得到 B.钾盐的氧化性比钠盐弱
C.钾盐的熔点比钠盐高 D.钠盐的吸湿性比钾盐强
17.我国合成一种含铊(Tl)的超导用的材料, 铊原子核外电子排布为2、8、18、32、18、3。下列说法不正确的是:
A.它的最高氧化物水化物的化学式为Tl(OH)3 B.其水化物的水溶液呈碱性
C.它的单质比Al单质的熔点要低 D.它不能置换酸中的氢
18.对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:① 加热时放出的气体可以使品红溶液褪色;② 加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;③ 加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。对于下列物质不能确认其在溶液中是否存在的是
A. Br- B. SO42- C. H2SO3 D. NH4+
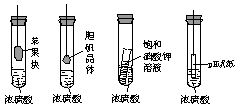 19.在右下图的实验装置中,从实验开始过一段时间,对看到的现象叙述不正确的是
19.在右下图的实验装置中,从实验开始过一段时间,对看到的现象叙述不正确的是
A. 苹果块会干瘪
B. 胆矾晶体表面有“白斑”
C. 小试管内有晶体析出
D. pH试纸变红
20.从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O====7Cu2S+5FeSO4+12H2SO4.下列说法正确的是( )
A.Cu2S既是氧化产物又是还原产物 B.5molFeS2发生反应,有10mol电子转移
C.产物中的SO42-离子有一部分是氧化产物 D.FeS2只作还原剂
21.20℃时,饱和KCl溶液的密度为1.174g·cm-3,物质的量浓度为4.0mol·L-1,则下列说法中不正确的是
A.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1
B.此溶液中KCl的质量分数为![]()
C.20℃时,密度小于1.174g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174g·cm-3
22.下列各选项所述的两个量,前者一定大于后者的是
① F2和Br2的沸点②纯水在25℃和80℃时的pH值③同温下分别在100g水中最多能
溶解的无水CuSO5和CuSO5·5H2O的质量④25℃时,等体积的pH值都等于3的盐酸和AlCl3溶液中,已电离的水分子数⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数⑥耐火材料MgO和CaO的熔点⑦H-和H+离子半径⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
A ①②⑥ B ①②③⑤ C ⑤⑥⑦ D ②⑥⑦
![]() 23.(10分)工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图。反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):
23.(10分)工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图。反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):
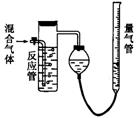 SO2+I2+2H2O→H2SO4+2HI
SO2+I2+2H2O→H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于___________的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量______(选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用_________代替(填写物质名称)。
(4)若碘溶液体积为Va mL,浓度为c mo1/L。N2与O2的体积为VbmL(已折算为标准状况下的体积)。用c、Va、Vb表示SO2的体积百分含量为:______________________。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为_______(选下列仪器的编号)。 a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f. 单孔塞 g.双孔塞
24.(12分)有A、B、C、D、E、F六种物质,它们的每个分子中均含有18个电子,请根据要求回答问题:
(1)A物质是由两种元素组成,且在空气中能发生自发燃烧,燃烧过程中产生固体X,X是原子晶体。则A物质的电子式为___________。B物质也只由两种元素组成,常温下为一种气态有机物,其化学式为____________。C物质是一种正在开发运用为汽车燃烧的液态有机物,其结构简式为_____________。
(2)D、E之间可以发生氧化还原反应,放出大量的热,且无任何污染。已知D由两种非金属元素组成,常用作火箭燃料,且分子中原子个数比为1:2,E也由两种非金属元素组成,是一种“绿色”氧化剂。请写出该反应的化学方程式______________________。
(3)F物质由3种元素组成,将2.24L(标准状况)气体F在氧气中充分燃烧后,得到由三种气体组成的混合气(在1atm,120℃下),其中两种是氢化物,分子中均含10个电子。再将该混合气(在1atm,120℃)通入到足量的a g澄清石灰水中,充分反应后,得到白色沉淀,该沉淀由两种成分组成。则F物质的化学式为_______________,最终溶液的质量为_____________g。(用含字母a的式式表示)
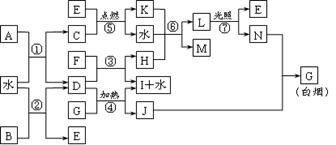 25.(10分)下图表示各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,I常用作干燥剂。
25.(10分)下图表示各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,I常用作干燥剂。
请按要求填空:⑴G的电子式是____;
⑵反应⑥的化学方程式是__________________________________,反应⑤在空气中发生时的现象是________________________________,已知C的燃烧热是1300 kJ·mol-1,表示C的燃烧热的热化学方程式是____________________________。
⑶根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是___________。
23.[答案] (1)不能;在酸性溶液中,NO3-能将SO32-氧化成SO42-,造成结果错误;
(2)保证得到的沉淀都是BaSO4,没有BaSO3;
(3)连续两次称量的质量不变;
![]()
24.(1) ,C2H6,CH3OH
,C2H6,CH3OH
(2)N2H4+2H2O2=N+4H2O
(3)CH3F,a-5.6
25.⑴![]() ⑵Ca(ClO)2+CO2+H2O=CaCO3+2HClO 火焰明亮并伴有浓烈黑烟 CH≡CH(g)+
⑵Ca(ClO)2+CO2+H2O=CaCO3+2HClO 火焰明亮并伴有浓烈黑烟 CH≡CH(g)+![]() O2(g)→2CO2(g)+H2O(l);ΔH=-1300 kJ·mol-1(热化学方程式中数据与本答案不同不给分) ⑶CaO2
O2(g)→2CO2(g)+H2O(l);ΔH=-1300 kJ·mol-1(热化学方程式中数据与本答案不同不给分) ⑶CaO2