高三化学一轮复习化学平衡练习
1、在一密闭容器中,反应 aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )
A.平衡向正反应方向移动了 B.平衡向逆反应方向移动了
C.物质B的质量分数增加了 D.a<b
2、某温度下,在一容积可变的容器里,反应2A(g) ![]() B(g) + 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是
B(g) + 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是
A.充入1mol稀有气体氦(He),平衡将向正反应方向移动
B.充入A、B、C各1mol,平衡将向正反应方向移动
C.将A、B、C各物质的量都减半,C的百分含量不变
D.加入一定量的A气体达平衡后,C的百分含量一定增加
3、一定温度下,将2molA、2molB、2molC的气体混合物充入一体积不变的密闭容器中,充分反应后恢复到起始温度,测得容器内的压强比起始时增大20%,则容器中可能发生的反应是
A.2A+B![]() 2C B.A+B
2C B.A+B![]() 2C C.2A+B
2C C.2A+B![]() C D.A+B
C D.A+B![]() 3C
3C
4、某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0
2Z(g);ΔH<0
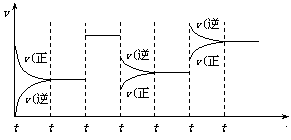 |
上图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
A.t2时加入了催化剂 B.t3时降低了温度
 C.t5时增大了压强
D.t4~t5时间内转化率最低
C.t5时增大了压强
D.t4~t5时间内转化率最低
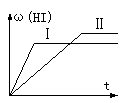
5、将1mol H2(g)和2mol I2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+ I2(g) ![]() 2HI(g);△H<0,并达到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅱ)所示,若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是 ( )
2HI(g);△H<0,并达到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅱ)所示,若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是 ( )
A、恒温恒容条件下,加入适当催化剂 B、恒温条件下,缩小反应容器体积
C、恒容条件下升高温度 D、恒温条件下,扩大反应容器体积
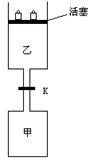 6、(10分)如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
6、(10分)如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
3A(g)+2B(g)![]() C(g)
C(g)![]() +2D(g);ΔH<0
+2D(g);ΔH<0
达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
(1)乙中B的转化率为 ;
(2)甲中D和乙中C的物质的量比较: (填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为 (用含V的代数式表示,连通管中气体体积忽略不计。)
7、(9分)在一个密闭容器中,有一个左右可滑动隔板,两边分别进行可逆反应,各物质的量如下:M、N、P为2.5mol、3.0mol、1.0mol。A、C、D各为0.50mol,B的物质的量为x,当x的物质的量在一定范围内变化,均可以通过调节反应器的温度,使两侧反应均达到平衡,且隔板在反应器的正中位置。达到平衡后,测得M的转化率为75%,填写空白:
⑴达到平衡后,反应器左室气体总的物质的量为 _____mol。
⑵若要使右室反应开始时V正 >V逆,x的取值范围 ______。
⑶若要使右室反应开始时V正 <V逆,x的取值范围 ______。
8、(14分)在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:
![]() C(s)+H2O(g)
CO(g)+H2(g)。
C(s)+H2O(g)
CO(g)+H2(g)。
试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是 (选填序号)。
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n molCO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 molH—O键
(2)若上述化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小容积、其它条件不变。下同),则容器内气体的平均相对分子质量面将 (填写不变、变小、 变大)。
(3)若上述化学平衡状态从正、逆两反应同时建立[即起始时同时投放C(s)、H2O(g)、 CO(g)、H2(g)],达到平衡后,试讨论:
①容积内气体混合物的平均相对分子质量![]() 的取值范围是
。
的取值范围是
。
②若给平衡体系加压,请参照起始投放的气体物质的平均相对分子质量(设定为![]() 1),分别给出
1),分别给出![]() 的变化(请填写条件和结论):
的变化(请填写条件和结论):
; ;
。
参考答案
1、B2、AC3、CD4、A5、C
6、(1)20%(4分)(2)后者大 (2分) (3)0.29V(4分)
7、(9分)⑴3.5mol ⑵2.0<x<4.0 ⑶1.5<x<2.0
8、 (14分) (1) BD(4分) (2)变大(2分)
(3)① 2<![]() <28(2分) ②若
<28(2分) ②若![]() 1<12
则
1<12
则![]() 变小;若
变小;若![]() 1=12,则
1=12,则![]() 不变;
不变;![]() 1
>12则
1
>12则![]() 变大。(各2分,共6分) (顺序不限)。
变大。(各2分,共6分) (顺序不限)。