高三化学一轮复习教案学案——原电池的原理及应用
[考纲要求]
1.理解原电池原理;
2.初步了解化学电源,了解化学腐蚀和电化学腐蚀及一般防腐蚀方法。
[案例分析]
一、原电池原理
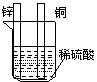
[例题1]对下图中装置加以必要的连接并填空:
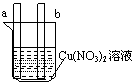 | |||
 | |||
A B
(1)在A图中,使铜片上冒H2气泡.请加以必要连接,连接后的装置叫 。电极反应式: 锌板铜板:
(2)图B中,ab为惰性电极,使a极板上析出铜,则b极板上析出
加以必要的连接后,该装置叫 。电极反应式:a极
B极 。
[变式训练]
1.将A中稀H2SO4改为CuSO4溶液,写出电极反应式
2.A中电子流向:
[小结]:负极:氧化反应
正极:还原反应(溶液中易得电子阳离子得电子)Ag+>Cu2+>H+
![]()
![]() 电子流向:负极 导线 正极
电子流向:负极 导线 正极
二、原电池的电极反应式的书写与正误判断
紧扣:负极:氧化反应 正极:还原反应
[例题2]已知下列原电池的总反应式,请写出电极反应式
(1)Cu+2FeCl3==CuCl2+2FeCl2 (2)CH4+O2+KOH==K2CO3+3H2O
负极:Cu-2e-== Cu2+ 负极:CH4-8 e-+10OH-== CO32-+7H2O
正极:2Fe3++2 e-==2Fe2+ 正极:2 O2+7H2O+8 e-==8OH-
[小结]书写原电池电极反应式的基本思路:
(1)负极:还原剂-n e-==氧化产物 正极:氧化剂+ n e-==还原产物
(注意分析参与电极反应产生的粒子能否与电解质反应,如能反应,写反应后的产物。如例2的负极反应)。
[例题3]将例题2中的反应(1)设计成原电池。画出装置图并注明电极材料及电解质溶液的名称。
点拨:(1)确定两极的电极材料(图中应注明)
(2)确定电解质溶液(图中不能漏画)
(3)画图要规范
新型电池分析
[例题4]阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池反应为2H2+O2==2H2O,电解液为KOH,反应保持在较高温度,使H2O蒸发,下列叙述正确的是( D )
A、此电池能发出蓝色火焰
B、H2为正极,O2为负极
C、工作时,电解液的pH不断减小
D、电极反应为:负极2 H2+4 OH--4e-==4 H2O
正极O2+2H2O+4e-==4 OH-
[变式训练]
(1)把电解质溶液改为稀H2SO4,电极反应式
(2)把H2改为CH4,电解质溶液为KOH溶液,电极反应式
(3)把H2改为CH4,电解质溶液为稀H2SO4溶液,电极反应式
[小结]书写原电池电极反应式的基本思路:
(2)对于有H、O参与的电极反应:
①总反应式中没有H+或OH-参与反应,则若一极消耗H+或OH-,另一极必生成H+或OH-
②H2在酸性介质中放电生成H+,在碱性介质中放电,与OH-结合生成H2O
O2在酸性介质中放电与H+结合生成H2O,在碱性介质中放电生成OH-
③氢氧不够,水来凑
 [例题5](05苏14) 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
[例题5](05苏14) 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
下列叙述不正确的是 (AD)
A.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO![]() + 4H2O
+ 4H2O
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
点拨:(1)新型电池的电极判断、电极反应式书写判断等问题仍紧扣原电池原理;
(2)解决“可充电电池”有关问题时,弄清是“充电”还是“放电”,充电为电解池,放电为原电池。
 [反馈练习]镊铬(Ni--Cd)可充电电池在现代生活中有广泛应用。它的充放电过程按式进行:Cd(OH)2+2 Ni(OH)2
Cd+ NiO(OH)+2H2O。由此可知,该电池放电时的负极材料是
[反馈练习]镊铬(Ni--Cd)可充电电池在现代生活中有广泛应用。它的充放电过程按式进行:Cd(OH)2+2 Ni(OH)2
Cd+ NiO(OH)+2H2O。由此可知,该电池放电时的负极材料是
A、Cd(OH)2 B、Ni(OH)2
C、Cd D、NiO(OH)
三、金属的腐蚀与防护
腐蚀快慢的判断方法:
电解原理引起的腐蚀>原电池原理引起的腐蚀>有防腐措施引起的腐蚀