高三化学元素化合物专项训练
1.氯气可用来消灭田鼠,为此将氯气通过软管灌入洞中,这是利用了Cl2下列性质中的
①黄绿色 ②密度比空气大 ③有毒 ④较易液化 ⑤溶解于水
A.①②③ B.②③ C.③④ D.③④⑤
2.已知HIO既能和酸又能和碱发生中和反应,则它与盐酸反应的产物是
A.IO- B.H2O C.HI D.ICl
3.为了防止Cl2中毒,可用浸透某种物质溶液的毛巾捂住口鼻。该物质在下列物质中的最佳选择是
A.NH3 B.SO2 C.KI D.Na2CO3
4.氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是
A.35Cl原子所含质子数为18 B.![]() mol的1H35Cl分子所含中子数约为6.02×1023
mol的1H35Cl分子所含中子数约为6.02×1023
C.3.5 g的35Cl2气体的体积为2.24 LD.35Cl2气体的摩尔质量为70 g·mol-1
5.下列反应都是用盐酸制Cl2,为制得等量Cl2,消耗盐酸最少的是
A.MnO2+4HCl![]() MnCl2+Cl2↑+2H2O B.2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
MnCl2+Cl2↑+2H2O B.2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
C.KClO3+6HCl===KCl+3Cl2↑+3H2O D.4HCl+O2![]() 2H2O+2Cl2↑
2H2O+2Cl2↑
6.今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体(m mol),在乙瓶中加入少量的NaHSO3晶体(m mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度大小关系是(溶液体积变化忽略不计)
A.甲=乙>丙 B.甲>丙>乙C.丙>甲=乙 D.乙>丙>甲
7.将0.15 mol的MnO2与过量的12 mol·L-1的浓盐酸反应,和50 mL 12 mol·L-1的浓盐酸与足量的MnO2反应两者产生的Cl2相比(其他反应条件相同)
A.一样多 B.前者较后者多 C.后者较前者多 D.无法比较
8.F2是氧化性最强的非金属单质。在加热条件下,等物质的量的F2与烧碱完全反应,生成NaF、H2O和另一种气体。该气体可能是A.H2 B.HFC.O2 D.OF2
9.我国政府规定,国内销售的食盐必须加碘。关于加碘盐的下列叙述中不正确的是
A.食用加碘盐,以确保人体对碘的摄入量B.加碘盐中加入的是碘酸钾
C.加碘盐中不能同时加入碘酸钾和碘化钾D.加碘盐中加入的是单质碘
10.氯化溴(BrCl)和Br2、Cl2具有相似的性质,下列有关氯化溴性质的判断中错误的是
A.在CCl4中的溶解性BrCl<Br2B.BrCl氧化性比Br2强,比Cl2弱
C.沸点BrCl>Br2 D.常温下BrCl可与NaOH溶液反应生成NaCl和NaBrO
11.有A、B、C三种物质,它们是Cl2、HCl、HBr,A、B、C不知分别是哪一种,已知A、B混合不反应,则下列结论中正确的是
A.C绝不是HCl B.A、B能确定 C.C可能是HCl D.C不是Cl2就是HBr
12.氟是最活泼的非金属,能体现这一结论的是
A.氢氟酸是一元弱酸B.氢氟酸能腐蚀玻璃C.NaF是一种农药D.氟能与Xe发生化合反应
14.在含有FeBr2和FeI2的混合溶液中通入足量的氯气然后把溶液蒸干并将残渣灼烧,得到的残渣是
A.FeCl2、Br2、I2 B.FeCl3、I2 C.Fe(OH)3、I2 D.Fe2O3
15.碘是原子半径较大的卤族元素,可能呈现金属性,下列事实能说明这个结论的是
A.已制得了IBr、ICl等卤素互化物 B.已经制得I2O5等碘的氧化物
C.已经制得I(NO3)3、I(ClO4)3·2H2O等含I3+的化合物 D.I2易溶于KI等碘化物溶液,形成I![]()
16.已知氯化碘(ICl)性质类似于卤素,有很强的化学活性。ICl跟Zn、H2O分别发生如下反应:2ICl+2Zn===ZnCl2+ZnI2、ICl+H2O===HCl+HIO,下列叙述正确的是
A.在Zn跟ICl的反应中,ZnI2既是氧化产物又是还原产物
B.在Zn跟ICl的反应中,ZnCl2既不是氧化产物又不是还原产物
C.在H2O跟ICl的反应中,ICl既是氧化剂又是还原剂
D.在H2O和ICl的反应中,ICl既不是氧化剂也不是还原剂
17.氰气的分子式为(CN)2,它的性质和卤素相似,称为拟卤素,对其性质和有关化合物性质的叙述正确的是A. NaCN和AgCN都易溶于水 B. HCl和HCN都易形成白雾
C.(CN)2易溶于水也易溶于NaOH溶液D.(CN)2和NaOH溶液反应生成NaCN、NaCNO和H2O18.酸根RO![]() 所含电子数比硝酸根NO
所含电子数比硝酸根NO![]() 的电子数多10,则下列说法正确的是
的电子数多10,则下列说法正确的是
A.R原子的电子层数比N的电子层数多1B.RO![]() 中R的化合价与NO
中R的化合价与NO![]() 中N的化合价相等
中N的化合价相等
C.RO![]() 和NO
和NO![]() 只能被还原,不能被氧化 D.R与N为同族元素
只能被还原,不能被氧化 D.R与N为同族元素
19.(上海高考题)过氧化氢的沸点比水高,但受热容易分解。某试剂厂先制得7%~8%的过氧化氢溶液,再浓缩成30%溶液时,可采用的适宜方法是
A.常压蒸馏 B.减压蒸馏 C.加生石灰常压蒸馏 D.加压蒸馏
20.下列叙述不正确的是
A.硒可以与钠组成化合物Na2Se B.硒化氢水溶液的酸性比氢硫酸弱
C.硒酸的酸性比硫酸的酸性弱 D.硒化氢在空气中完全燃烧时,生成二氧化硒和水
21.碲元素及其化合物不可能具有的性质是
A.碲的化合价有-2价、+4价、+6价 B.碲的氧化物有TeO2和TeO3
C.碲能与氢气直接化合,且H2Te比H2Se稳定D.单质碲呈银白色,还原性比硒强
22.含有硒的保健品已开始进入市场,已知硒元素与钾元素同周期,则下列关于硒的叙述不正确的是
A.原子序数为24B.气态氢化物为H2SeC.非金属性比溴弱D.最高价含氧酸为H2SeO4
23.下列有关硫化氢性质的说法正确的是
A.给盛硫化氢的容器加热会产生黄色物质 B.由于硫化氢不稳定,所以久置的氢硫酸会变浑浊
C.硫化氢具有强还原性,故氢硫酸在反应中只能作还原剂
D.氢硫酸是弱酸,无法通过复分解反应制取强酸
24.下列物质中既能与H2S反应,又能与溴水反应的是
A.FeSO4溶液B.Na2S溶液C.CuSO4溶液D.氯水
25.同温同压下燃烧20 mL H2S用去O2 16 mL,则充分燃烧的H2S与不充分燃烧的H2S的质量之比为 A .1∶2 B.2∶3 C.7∶3 D.3∶7
26.关于O3的说法中错误的是
①O3具有刺激性臭味,因此被称为“臭氧”②O2与O3是氧元素的同素异形体
③O3比O2密度大,也比O2易溶于水 ④O3比O2稳定,高温下不易分解
⑤臭氧有漂白和消毒作用⑥空气中微量O3可以刺激中枢神经,加快血液循环,因此空气中O3含量越高越好⑦空气中高压放电、高压电机和复印机工作都会有O3生成
A.①②③ B.④⑤⑥ C.④⑥ D.⑤⑦
27.下列能说明元素R一定为氧族元素的是
A.R为非金属元素,其氧化物对应水化物分子式为H2RO3B.R的单质与H2化合成H2R
C.R的单质与铝化合成Al2R3 D.R的氢化物的水溶液呈酸性
28.若要从CO2气体中除去少量SO2,最好使混合气体通过
A.盛NaOH溶液的洗气瓶B.盛KMnO4酸性溶液的洗气瓶C.盛品红溶液的洗气瓶
D.盛饱和NaHCO3溶液的洗气瓶
30.SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02 mg·L-1。下列措施中不能够减少SO2排放量的是
A.用天然气代替煤炭做民用燃料 B.开发新型燃器提高热能利用率
C.硫酸厂采取措施提高尾气的吸收率 D.燃煤中加入生石灰后使用
31.SO2和Cl2都具有漂白性。若将等物质的量的这两种气体同时作用于潮湿的有色物质,可观察到有色物质 A.立刻褪色 B.慢慢褪色C.先褪色,后复原 D.颜色不褪
32.向FeCl3和BaCl2的酸性混合液中通入SO2气体,有白色沉淀生成,此沉淀是
A.BaSO4 B.FeS C.BaSO3 D.S
33.在常温下将a L SO2和b L H2S混合,当反应后气体体积为反应前气体体积的1/4时,则a与b之比为 A.1∶1 B.1∶2 C.1∶3 D.2∶1
34.下列关于SO2的叙述,不正确的是
A.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物B.SO2是亚硫酸的酸酐
C.大气中SO2的主要来源是含硫物质的燃烧 D.SO2具有氧化性,因而可以使品红溶液褪色
35.下列反应发生后,溶液中H+浓度显著增大的是
A.将SO2通入溴水中B.将SO2通入品红溶液中C.将H2S通入CuSO4溶液中D.将Cl2通入KI溶液
36.为了除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是
①饱和Na2SO4溶液;②饱和NaHCO3;③浓硫酸;④灼热的铜网;⑤碱石灰。
A.①③④ B.②③④ C.②④③ D.③④⑤
37.一定物质的量的SO2与NaOH溶液反应,所得产物中含Na2SO3和NaHSO3物质的量之比为3∶5,则参加反应的SO2与NaOH物质的量之比为
A.1∶2 B.3∶5 C.8∶11 D.18∶8
38.下列四种溶液中,一定存在SO![]() 的是
的是
A.向甲溶液中加入BaCl2溶液,产生白色沉淀
B.向乙溶液中加入BaCl2溶液,有白色沉淀,再加入盐酸沉淀不溶解
C.向丙溶液中加入盐酸使之酸化,再加入BaCl2溶液,有白色沉淀产生
D.向丁溶液中加入硝酸酸化,再加入硝酸钡溶液,有白色沉淀产生
39.已知98%的浓H2SO4的浓度为18.4 mol/L,则49%的硫酸溶液的浓度为
A.9.2 mol/L B.大于9.2 mol/LC.小于9.2 mol/L D.不能确定
40.向50 mL 18 mol/L硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量(n)为
A.n=0.9 mol B.0.45 mol<n<0.9 molC.n=0.45 mol D.n<0.45 mol
41.在200 mL 0.5 mol·L-1 NaOH溶液中,加入一定量SO3,在一定条件下蒸发所得溶液,析出的固体物质只有5.0 g,该固体物质的成分可能是(固体物质均不含结晶水)
A.Na2SO4 B.NaHSO4 C.NaOH和Na2SO4 D.Na2SO4和NaHSO4
42.利用废铜屑制取CuSO4溶液最好的方法是
A.铜屑和浓硫酸混合加热 B.铜屑在空气中燃烧后再溶于稀H2SO4
C.铜屑与稀硫酸混合加热 D.铜屑在空气中灼烧后再溶于浓H2SO4
43.各取pH=2的H2SO4和H2SO3溶液350 mL,分别稀释5倍后,再分别加入0.1 g Zn,在相同条件下让它们充分反应,则
A.两者放出H2体积一样 B.H2SO4放出的H2比H2SO3放出的H2体积小
C.H2SO4放出的H2比H2SO3放出的H2体积大D.H2SO4的反应速率比H2SO3的反应速率快
44.在硫酸的工业生产中,下列生产操作及对生产操作主要原因的说明二者都正确的是
A.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
B.硫铁矿燃烧前需要粉碎,因为大块的不能燃烧
C.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以使SO3吸收完全
D.SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率
45.下列各组气体中,在实验室可用硫酸制取,又能用浓H2SO4干燥的一组是
A.HCl、HBr、H2 B.H2S、CO2、H2 C.H2、SO2、HCl D.NH3、HF、H2
46.下列气体中最易液化的是 A、N2 B、O2 C、NH3 D、H2
47、既能用浓硫酸,又能用碱石灰干燥的气体是A、Cl2 B、SO2 C、NO D、NH3
48、下列物质中既能与稀硫酸反应,又能与烧碱溶液反应的是
A、NH4Cl B、NH4HS C、NaHCO3 D、FeS
49、下列各组物质的空间构型完全不同的是
A、NH3和H3O+ B、NH4+和CH4 C、CO2和SiO2 D、金刚石和晶体硅
50、下列各组气体,在通常条件下能稳定共存的是
A、NH3、O2、HCl B、N2、H2、HCl C、CO2、NO、O2 D、H2S、O2、SO2
51、某混合气体可能有CO、CO2、NH3、HCl、H2和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象),氢氧化钡溶液(有浑浊现象)。浓H2SO4、灼热的氧化铜(变红)和无水硫酸铜(变蓝)时,则可断定该混合气体中一定有
A、HCl、CO2、H2 B、CO、H2、H2O C、CO、H2、NH3 D、HCl、CO、H2O
52、氨水中含氮的微粒最多的是 A、NH3 B、NH3·H2O C、NH4+ D、OH-
53、下列混合物可用加热方法分离的是
A、碘和氯化铵 B、硫酸钾和氯酸钾 C、氯化铵和硫酸钡 D、碳酸氢钠和碳酸氢铵
54、限用一种试剂,经过一次性实验就能鉴别Na2CO3、(NH4)2SO4、NH4Cl、KNO3溶液,应选用
A、AgNO3溶液 B、NaOH溶液 C、Ba(OH)2溶液 D、盐酸
55、下列各组离子在水溶液中能大量共存的是
A、CO32-、H+、HCO3-、Ca2+ B、NH4+、OH-、Ba2+、NO3-
C、I-、ClO-、NO3-、H+ D、SO32-、SO42-、Na+、OH-
56.下列有关硝酸化学性质的叙述中正确的是( )
A、浓、稀硝酸都能使蓝色石蕊试剂变红B、硝酸(过量)能与Na2SO3反应,但不生成SO2
C、稀硝酸可与Na2S反应制得H2S D、在碘化钾淀粉溶液中滴加稀硝酸溶液呈蓝色
57.污染环境的有害气体中,主要由于跟血红蛋白作用而引起中毒的有毒气体是( )
A、SO2 B、CO2 C、NO D、CO
58.某二价金属跟硝酸反应时,金属与硝酸所消耗的物质的量之比为2:5,则反应中唯
一的还原产物可能是( )
A、NH3 B、N2O C、NO D、NO2
59.可不用棕色瓶存放,但必须用玻璃塞试剂瓶存放的药品是( )
A、氯水 B、硝酸银溶液 C、液溴 D、烧碱
60.Cu粉放A稀H2SO4中,加热后也无现象,当加入一种盐后,Cu粉质量减少,而
溶液变蓝,同时有气体生成,此盐是( )
A、氯化物 B、硫酸盐 C、硝酸盐 D、磷酸盐
61.下列酸的酸酐难以由单质间直接化合生成的有( )
A、H2CO3 B、HNO3 C、H2SO3 D、H2SO4
62.下列反应中,既能表现出硝酸的酸性,又能表现出其氧化性的是( )
A、Fe2O3+HNO3 B、Al (OH)3+HNO3 C、C+HNO3(浓) D、Cu+HNO3
63.当三份Cu粉分别与过量的稀硝酸、浓硝酸、热的浓硫酸反应后,收集到的气体在
相同状况下体积相等时,三份Cu粉的质量比为(不考虑NO2转化成N2O4和反应生成气体的溶解)
A、3:1:2 B、3:2:2 C、1:1:2 D、2:6:3
64.下列关于浓硝酸和浓硫酸的叙述,正确的是( )
A、常温下都能用铝容器贮存 B、常温下都能与铜较快反应
C、露置在空气中,容器内酸液的质量都减少 D、露置在空气中,容器内酸液的浓度均降低
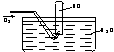 65.按右图进行实验,试管内装有12mLNO,然后间歇而缓慢
65.按右图进行实验,试管内装有12mLNO,然后间歇而缓慢
地通入8mLO2。下面有关实验最终状态的描述正确的是( )
A、试管内气体呈棕红色 B、试管内气体为无色是NO
C、试管内气体为无色是O2 D、试管内液面高度上升
66. 46g金属钠在空气中充分燃烧得到淡黄色粉末,该粉末与足量的水反应放出气体的体积是(标准状况下)
A.44.8L B.11.2L C.22.4L D.5.6L
67.氢化钠(NaH)是一种白色的离子晶体,其中钠是+1价。NaH与水作用放出氢气,下列叙述中正确的是 ( )A.NaH在水中显酸性 B.NaH中氢离子的电子层排布与氦原子相同
C.NaH中氢离子半径比锂离子半径大D.NaH中氢离子可被还原成氢气
68.下列物质的溶液既能与H+反应,又能与OH-反应的是
A.MgSO4 B.Na2CO3
C.NaHCO3 D.(NH4)2SO4
69.将一小块金属钾投入下列物质的溶液中,既能放出气体,又有沉淀析出的是 ( )
A.MgCl2 B.BaCl2 C.CuCl2 D.NaHCO3
70.下列关于碱金属的叙述中,正确的是 ( )
A.碱金属都可以保存在煤油中 B.碱金属与水反应均漂浮在水面上
C.碱金属在空气中加热均可生成多种氧化物 D.碱金属的硬度小、密度小、熔点低
71.下列关于纯碱晶体(Na2CO3·10H2O)的叙述中,错误的是 ( )
A.将晶体放置在空气中质量会减轻 B.加热晶体则生成NaHCO3
C.Na2CO3可作为干燥剂使用 D.晶体溶于水后呈碱性
72.相同质量的Na、Mg、Al分别与过量的盐酸反应,在相同条件下置换出H2的体积比是 ( )
A.36∶69∶92 B.23∶12∶9 C.1∶2∶:3 D.9∶12∶23
73.有关镁的下列叙述中错误的是 ( )
A.能与NH4Cl溶液作用放出氢气 B.与冷水剧烈反应,生成Mg(OH)2沉淀并放出氢气
C.在CO2中能继续燃烧,所以金属镁着火,不能用CO2去灭火
D.在通常情况下其表面有一层致密的氧化膜,所以抗腐蚀能力很强
74.有无色溶液,加入Na2O2时有无色无味气体放出,并有白色沉淀生成,加入Na2O2的量与生成白色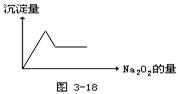 沉淀的量如图3-18所示。该无色溶液中含有的物质是 ( )
沉淀的量如图3-18所示。该无色溶液中含有的物质是 ( )
A.CaCl2和MgCl2
B.Al2(SO4)3
C.Al2(SO4)3和MgSO4
D.Na2SO4和MgSO4
75.相同质量的镁条分别在下列气体中充分燃烧,所得固体物质的质量最大的是 ( )
A.O2 B.N2 C.CO2 D.空气
76.用纯净的铂丝蘸取某无色溶液在无色火焰上灼烧,火焰呈黄色,说明该溶液中金属离子
A.只有Na+B.可能有Na+、也可能有K+C.一定有K+D.一定有Na+、也可能有K+
77.电子工业制造光电管时,需要一种经强光照射就失电子而接通电路的材料,制造这种材料的物质应属于
A.放射性元素 B.ⅦA族元素C.卤化银 D.ⅠA族元素
78.某温度下,w g某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加w g。在①H2②CO ③CO和H2的混合气 ④HCHO ⑤CH3COOH
⑥HO—CH2—CH2—OH中,符合题意的是
A.均不符合 B.只有①②③C.只有④⑤ D.全部符合
79.已知锂及其化合物的许多性质与碱金属差异较大,却与镁相似。下面有关锂及其化合物性质的叙述不正确的是A.锂在过量氧气中燃烧主要产物是氧化锂而不是过氧化锂B.碳酸锂受强热很难分解
C.碳酸锂的溶解度比碳酸氢锂的大 D.锂可以与氮气化合生成氮化锂(Li3N)
80.已知钡的活泼性介于钠和钾之间,下列说法中正确的是
A.钡可以从氯化钠溶液中置换出钠 B .钡可以从氯化铜溶液中置换出铜
C.钡可以从冷水中置换出氢而得到氢气D.在水溶液中,钡离子可以氧化金属钠
81.Na3N与NaH均为离子化合物,都能与水反应放出气体。下列有关叙述正确的是
A.二者中Na+半径都比阴离子大 B.与水反应时,水都作氧化剂
C.与水反应所产生的气体都能使湿润的红色石蕊试纸变蓝
D.二者与盐酸反应,前者可产生两种盐,后者只有一种盐生成。
82.将2.3 g钠与另一种金属元素组成的合金放入足量盐酸中,完全反应时收集到1.13 L H2(标准状况),则另一种金属可能是①K ②Mg ③Al ④Li ⑤Rb ⑥Fe
A.①⑤⑥ B.①⑤ C.②③④ D.①②③④
83.钾与氧组成的某种离子晶体,含钾的质量分数是![]() ,其阴离子只有过氧离子O
,其阴离子只有过氧离子O![]() 和超氧离子O
和超氧离子O![]() 两种,则此晶体中,O
两种,则此晶体中,O![]() 与O
与O![]() 的物质的量之比为
的物质的量之比为
A.2∶1 B.1∶1 C.1∶2 D.1∶3
84.(2001年春季高考题)将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H2 2.8 L(标准状况),原混合物中的质量可能是A.2 g B.14 gC.8 g D.10 g
85.将某物质的量的镁和铝相混合,取等质量的该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是
A.3 mol·L-1 HClB.4 mol·L-1的HNO3C.8 mol·L-1 NaOHD.18 mol·L-1 H2SO4
86.人的纯净的胃液是一种强酸性液体,pH在0.9~1.5左右,氢氧化铝是一种治疗胃液过多的胃药的主要成分,目前这种胃药已不常用,原因主要是
A.长期摄入铝元素不利于人体健康B.它不能中和胃液
C.它不易溶于胃液 D.它的疗效太差
87.下列气体逐渐通入NaAlO2溶液中,开始时产生沉淀,继续通入气体时沉淀又溶解,该气体是
A.NO2 B.NOC.CO2 D.H2S
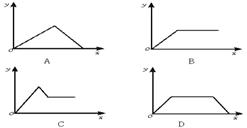
88.在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(x)与溶液中沉淀物的量(y)的关系示意图中正确的是
89.在氯化镁和硫酸镁的混合液中,若Mg2+与Cl-的物质的量浓度之比为4∶3时,下列判断正确的是
A.溶液中Mg2+与SO![]() 的物质的量浓度相等 B.溶液中Mg2+与SO
的物质的量浓度相等 B.溶液中Mg2+与SO![]() 物质的量浓度之比为5∶8
物质的量浓度之比为5∶8
C.溶液中Mg2+与SO![]() 物质的量浓度之比为8∶5D.溶液中氯化镁和硫酸镁物质的量相等
物质的量浓度之比为8∶5D.溶液中氯化镁和硫酸镁物质的量相等
90.将AlCl3溶液和NaOH溶液等体积混合得到的沉淀物和溶液中所含铝元素的质量相等,则原AlCl3溶液和NaOH溶液物质的量浓度之比可能是A.2∶3 B.1∶3C.1∶4 D.2∶7
91.m g钠、铝混合物,放入n g水中,反应停止后,仍有不溶物a g,则溶液中溶质为
A.NaOHB.NaAlO2C.NaOH和NaAlO2D.无法确定
92.将铝粉放入烧碱溶液中,若反应过程中有1.5 mol电子发生转移,则参加反应的水为
A.9 g B.18 gC.0.5 mol D.![]() mol
mol
93.(2002年全国高考题)铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为 A.Fe(OH)3;Fe2O3 B.Fe(OH)2;FeO
C.Fe(OH)2、Fe(OH)3;Fe3O4 D.Fe2O3;Fe(OH)3
94.要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时最佳顺序为
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液
A.①③ B.③②C.③① D.①②③
95.在氯化铁、氯化铜和盐酸混合液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是A.Cu2+ B.Fe3+C.Fe2+ D.H+
96.在FeCl3,CuCl2,FeCl2的混合溶液中,Fe3+,Cu2+和Fe2+的物质的量之比为3∶2∶1,现加入适量铁粉,使溶液中三种离子物质的量浓度之比变化为1∶2∶4,则参加反应的铁粉与原溶液Fe3+的物质的量之比为
A.2∶1 B.1∶2C.1∶3 D.1∶4
97.在浓度均为3 mol·L-1的盐酸和硫酸各100 mL中,分别加入等质量的铁粉,反应完毕后生成气体的质量比为3∶4,则加入铁粉的质量为
A.5.6 g B.8.4 gC.11.2 g D.1.8 g
98.把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到的红色粉末的质量仍为a g,则原合金中铁的质量分数为A.70% B.52.4%C.47.6% D.30%
99.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu===2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.烧杯中有铜无铁B.烧杯中有铁无铜C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
100.某强酸性溶液中可能存在NO![]() 、Cl-、I-、Fe3+中的一种或几种。向该溶液中加入溴水,单质溴被还原,由此推断溶液中
、Cl-、I-、Fe3+中的一种或几种。向该溶液中加入溴水,单质溴被还原,由此推断溶液中
A.不含NO![]() 、也不含Fe3+B.含有NO
、也不含Fe3+B.含有NO![]() 、I-、Cl-C.含I-,但不能确定是否含Cl-D.含有Fe3+
、I-、Cl-C.含I-,但不能确定是否含Cl-D.含有Fe3+