高三化学月考
可能用到的原子量Fe:56;Na:23;O:16;H:1;Cl:35.5;S:32;Ag:108;N:14;Cu:64;Ba:137;Mg:24
第Ⅰ卷:选择题Ⅱ(共50分)
一、选择题:(以下每题只有一个选项符合题意。2×10)
1、共价键、离子键和范德瓦尔斯力是构成物质粒子间的不同作用方式,下列物质中只含有上述一种作用的是( )
A、干冰 B、氯化钠 C、氢氧化钠 D、碘
2、在外加电场下氢氧化铁胶体微粒向阴极移动的原因是( )
A、Fe3+带正电荷
B、Fe(OH)3带负电吸引阳离子
C、在氢氧化铁胶体微粒吸附阳离子而带正电荷
D、氢氧化铁胶体吸附阴离子带负电荷
3、粘土胶体中,粘土带负电,为了使粘土粒子聚沉,下列物质中用量最少、最有效的电解质是( )
A、Al2(SO4)3 B、Na3PO4 C、BaCl2 D、K2SO4
4、24mL浓度为0.05mol/LNa2SO3溶液,恰好与20mL浓度为0.02mol/LK2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是( )。
A、 +6 B、0 C、 +2 D、 +3
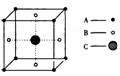 5、某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中 前后两面心上的B原子未能画出),该晶体的化学式是( )
5、某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中 前后两面心上的B原子未能画出),该晶体的化学式是( )
A、A6B8C B、A2B4C C、AB3C D、A3B4C
6、Zn+NH4NO3+2HNO3===Zn(NO3)2+N2↑+3H2O的反应中,参加 反应的锌和被还原的硝酸根的物质的量之比是( )
A、1∶1 B、1∶3 C、1∶2 D、3∶1
7、下列物质的沸点,由高到低排列顺序正确的是( )
A、O2 I2 Hg B、SiO2 NH3 NaCl
C、H2Te H2S H2Se D、Na K Rb
8、下列各组中的离子因发生氧化还原反应而不能大量共存的是( )
A、H+、Na+、SO![]() 、Cl- B、Ca2+、K+、S2-、CO
、Cl- B、Ca2+、K+、S2-、CO![]()
C、Fe2+、H+、Cl-、NO![]() D、HCO
D、HCO![]() 、Br-、OH-、SO
、Br-、OH-、SO![]()
9、能正确表示下列化学变化的离子方程式是( )
A、二氧化锰与浓盐酸反应 MnO2 + 4HCl = Mn2+ + 2Cl- + Cl2↑+2H2O
B、用稀硫酸清除铁锈 Fe2O3 + 6H+ = 2Fe3+ + 3H2O
C、CO2通入澄清石灰水中 CO2 + Ca(OH)2 = CaCO3↓+ H2O
D、钠和冷水反应 Na+2H2O=Na++H2↑+2OH-
10、下列有关胶体和溶液的比较正确的是( )
A、溶液中电解质产生的是阴、阳离子,胶体中只有胶体微粒带电
B、溶液中溶质的直径小于1×10-9m,胶体的直径在10-9m ~10-7m之间
C、通直流电后,溶液中溶质的粒子分别向两极运动,而胶体中的粒子向某一极运动
D、胶体具有丁达尔现象是胶体与溶液的本质区别
二、选择题:(每题有1—2个选项符合题意,少选得1分。2×15)
11、充分燃烧一定量的丁烷气体放出的热量为xQ,完全吸收它生成的CO2生成正盐,需5 mol/LKOH溶液100 mL,则丁烷的燃烧热为( )
A、16xQ B、8xQ C、4xQ D、2xQ
12、向某盐溶液中加适量氯水无明显现象,然后滴加盐酸酸化的Ba(NO3)2溶液产生白色沉淀,则该盐溶液中可能含有的离子是( )
A、Ag+ B、SO42- C、SO32- D、S2-
13、下列性质适合于分子晶体的是( )
A、熔点1070℃,易溶于水,水溶液导电
B、熔点10.31 ℃,液态不导电、水溶液能导电
C、能溶于CS2、熔点112.8 ℃,沸点444.6℃
D、熔点97.81℃,质软、导电、密度0.97 g/cm3
14、下列离子方程式书写正确的是( )
A、等物质的量的NaHCO3溶液和Ba(OH)2溶液混合
Ba2++HCO3-+OH-==H2O+BaCO3↓
B、碳酸钠溶液中加入等物质的量的乙酸
CO32-+CH3COOH==CH3COO-+ H2O + CO2↑
C、硫氢化钠的水解
![]() HS- + H2O H3O+
+ S2-
HS- + H2O H3O+
+ S2-
D、氯化铝溶液中加入过量的氨水
Al3+ + 4NH3•H2O==AlO2- + 4NH4++ 2H2O
15、下列各组离子,在指定的环境中一定能大量共存的是( )
A、pH=7的溶液中:Al3+、K+、SO![]() 、HCO
、HCO![]()
B、能使pH试纸变深蓝色的溶液中:S2-、Cl-、SO![]() 、Na+
、Na+
C、加入铝粉放出H2的溶液中:Cl-、AlO![]() 、I-、NO
、I-、NO![]()
D、由水电离出c(H+)=1×10-13 mol·L-1的溶液中:Fe2+、NH![]() 、Cl-、SO
、Cl-、SO![]()
16、已知I-、Fe2+、SO2、Cl-、H2O2都有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2。则下列反应不能发生的是( )
A、2Fe3+ + SO2 +2 H2O = 2Fe2+ + SO42- + 4H+
B、I2 + SO2 + 2H2O = H2SO4 + 2HI
C、H2O2 + H2SO4 = SO2 + O2 + 2H2O
D、2Fe2+ + I2 = 2Fe3+ + 2I-
17、将1.12 g铁粉加入2 mol·L-1 FeCl3溶液25 mL中,充分反应后,结果是( )
A、铁有剩余 B、生成0.07 mol Fe2+
C、反应后的溶液能使KSCN溶液变红色
D、反应后溶液中Fe2+和Fe3+的物质的量之比为6∶1
18、某单质能与足量浓硝酸反应放出NO2气体,若参加反应的单质和硝酸的物质的量之比为1∶a,则该元素在反应中所显示的化合价是( )
 A、+2a B、+a C、+
A、+2a B、+a C、+![]() D、+
D、+![]()
19、如图是NaCl的结构示意图,其中与每个Na+距离相等,且最近的Cl-所围成的空间几何构型是( )
A、正四面体B、正六面体C、正八面体D、正十二面体
20、若溶液中由水电离产生的c(OH-)=1×10-14mol/L,满足此条件溶液 中一定可以大量共存的离子组是( )
A、Al3+ Na+ NO3 - Cl- B、 K+ Na+ Cl- NO3-
C、K+ Na+ Cl- AlO2- D、K+ NH4+ SO42- NO3-
21、常温下,0.1mol/L的下列各物质的溶液中,阳离子的浓度最大的是( )
A、BaCl2 B、MgCl2 C、AlCl3 D、KNO3
22、38.4 g Cu跟适量的HNO3作用,铜全部反应后,共收集到气体22.4 L(标准状况),反应消耗的硝酸的物质的量可能是( )
A、1 mol B、2.2 mol C、1.6 mol D、2.4 mol
23、下列说法正确的是( )
A、金属的导电过程是物理变化
B、晶体中有阳离子时必有阴离子
C、金刚石、铝、氖等物质的晶体都是由原子组成的
D、二氧化硅、二氧化碳的晶体内都存在化学键
24、在反应:11P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4中,7.5 mol CuSO4可氧化磷原子的物质的量为( )
A、1.5 mol B、3 mol C、5 mol D、6 mol
25、下列各组物质,在只有水和试管的条件下,达不到鉴别目的的是( )
A、硝基苯、乙醇、乙酸乙酯
B、Na2O2、CaCl2、CuSO4、
C、CaCO3、NaHSO4、CaC2、Mg(OH)2
D、KCl、Na2SO4、AlC13、Mg3N2
第Ⅱ卷:非选择题(共58分)
三、填空题(本题包括5小题,共26分)
26、有甲、乙、丙、丁4种液体,它们分别是Fe(OH)3胶体、硅酸溶胶、As2S3胶体、NaOH溶液。现将有关试验现象记录如下:(1)电泳:甲液体的阳极周围颜色变浅,阴极周围颜色变深;(2)将一束光通过乙液体,无丁达尔现象;(3)将乙慢慢加入到丙液中,先出现聚沉,后液体变清。则甲为__________;乙为__________;丙为____________;
丁为____________。
27、已知:①P4(s、白磷)+5O2(g)===P4O10(s);ΔH= -2983.2 kJ·mol-1
②P(s、红磷)+![]() O2(g)=
O2(g)=![]() P4O10(s);ΔH=-738.5
kJ·mol-1,试写出白磷转化为红磷的热化学方程式
。
P4O10(s);ΔH=-738.5
kJ·mol-1,试写出白磷转化为红磷的热化学方程式
。
28、NaBH4作为还原剂,在有机化学中有极为广泛的用途。.
(1)NaBH4极易溶解于水并与水作用产生H2,反应后硼元素以BO2-形式存在于溶液中,此反应的离子方程式是
。
(2)该反应与溶液酸碱度有关,PH越小,反应速率越______理由是
。
(3)NaBH4可使许多金属离子还原为金属单质,例如它可以使含有金离子(Au3+)的废液中Au3+还原(碱性条件,此时硼仍然以BO2—形式存在),离子方程式是
。
29、2.3 g某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7 g水(液态)和2.24 L CO2(标况)并放出68.35 kJ热量,则该反应的热化学方程式为
。
30、某同学两次用2.6 g Zn和稀HNO3反应,两次所用的溶液中均含有6.3 g HNO3,但浓度不同,又知第一次实验中有1/5 HNO3被还原,第二次实验中只有1/10 HNO3被还原,试写出相应的化学反应方程式
第一次 。
第二次 。
四、实验题(本题包括1小题,共12分)
31、粉状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量的A进行铝热反应,产物中有单质B生成
②另取20gA全部溶于0.15L6.0mol/L的盐酸中,得溶液C
③将①中得到的单质B和溶液C反应,放出1.12L(标况)气体,同时生成溶液D,还残留有物质B;④用KSCN溶液检验时,溶液D不变色
请填空:(1)①中引发铝热反应的实验操作是
。
产物中的单质B是(化学式) 。
(2)②中发生的各反应的方程式是
。
(3)③中发生的各反应的离子方程式是
。
(4)若溶液D的体积视为0.15L,则该溶液中C(Mg2+)为_____________,
C(Fe2+)为_____________。
五、推断题(本题包括1小题,共8分)
32、某待测液中可能含有Fe2+、Fe3+、Ag+、Al3+、Ba2+、NH 4+
等离子,进行如下实验(所加酸、碱、氨水、溴水都是过量的)。
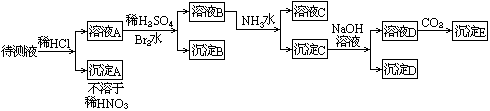 |
根据实验结果:
(1)溶液中一定存在的离子是:
(2)写出沉淀B的分子式: ,沉淀D的分子式:
(3)写出从溶液D生成沉淀E反应的离子方程式:
________________________________
化学答题纸
班级__________姓名__________得分__________
三、填空题(本题包括5小题,共26分)
26、甲为__________;乙为____________;丙为____________;丁为____________
27、热化学方程式是 ________________________。
28、(1)离子方程式是
_____________________________
_。
(2)______理由是 __________________。
(3)离子方程式是
____________________________。
29、热化学方程式
_________________ 。
30、
第一次 _____________________ 。
第二次 _________________ _。
四、实验题(本题包括1小题,共12分)
31、(1)①中引发铝热反应的实验操作是
______________________
________________________________________________________________________。
单质B是(化学式) 。
(2)②中发生的各反应的方程式是
_________________。
(3)③中发生的各反应的离子方程式是
_________________。
(4)C(Mg2+)为_____________,C(Fe2+)为_____________。
五、推断题(本题包括1小题,共8分)
32、(1)溶液中一定存在的离子是
__________。
(2)沉淀B的分子式 , D的分子式 。
(3)写出从溶液D生成沉淀E的反应的离子方程式
_________________________________________。
六、计算题(本题包括2小题,共12分)
32、在750mL0.10 mol·L-1 FeCl2溶液中通入一定量Cl2,待反应结束后,将溶液稀释到1 L,再取出1/10稀溶液加入足量AgNO3溶液,得到0.287 g沉淀。求原溶液中被氧化的
Fe2+占原溶液中Fe2+的物质的量分数。
33、密闭容器中使3.62gNaOH、Na2S、Na2SO3的混合物溶于500mL某浓度的稀H2SO4中,不放出任何的气体,再加入100mL 0.10 mol·L-1的Ba(OH)2溶液,正好中和过量的H2SO4。将反应所得沉淀分离、洗涤、干燥、称重,称其质量为3.29g。求:原混合物中各物质的物质的量之比。