高三化学上学期复习验收试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分。考试时间100分钟。
可能用到的相对原子质量: H—1 He-4 C—12 O—16 S—32 CI-35.5 Na-23 Mg—24 K-39 Ca-40 Fe—56 Cu-64 Zn—65
第Ⅰ卷(选择题 共51分)
一、(本题包括17小题,每小题3分,共51分,每小题仅一个选项符合题意)
1. 诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是
A.纤维素、脂肪 B.蛋白质、高级烃 C.淀粉、油脂 D.蛋白质、硬化油
2、一种新型灭火剂叫“1211”,其化学式为CF2ClBr,命名方法是按碳、氟、氯、溴的顺序分别以阿拉伯表示相应元素的原子数目(末尾的“0”可略去)。按此原则,对下列几种新型灭火剂的命名不正确的是 ( )
A. CF3Br-1301 B. CF2Br2-122 C. C2F4Cl2-242 D. C2ClBr2-2012
3、某地有甲、乙两工厂排放的污水各含有下列八种离子中的四种(不含相同离子):Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、NO3-、OH-,若两厂单独排放都会造成水污染,若将两厂的污水按一定比例混合,沉淀后污水便变为无色澄清只含硝酸钠排出,污染程度会大大降低,下列分析正确的是:( )
A.SO42-和NO3-可能来自同一工厂 B. Cl-和NO3-一定在不同工厂
C. Ag+和Na+可能在同一工厂 D. NaNO3来自同一工厂
4、NA表示阿佛加德罗常数,下列说法不正确的是
A 标准状况下,1.12LDT所含的中子数为0.15NA
B 8.0gCuO被CO完全还原,转移电子数为0.2NA
C 标准状况下,密度为d g/L的某气体纯净物一个分子的质量为22.4d /NAg
D.1L0.1mol/L的硫化钠溶液中硫离子数目为0.1NA
5.根据等电子原理:由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们具有相似的结构特征。以下各组微粒结构不相似的是
A.CO和N2 B.O3和NO- C.CO2和N2O D.N2H4和C2H4
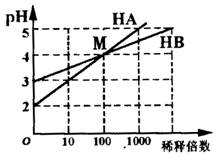 6.常温时将HA和HB两种一元酸的溶液分别加水稀释,pH变化如右图所示。下列叙述中正确的是
6.常温时将HA和HB两种一元酸的溶液分别加水稀释,pH变化如右图所示。下列叙述中正确的是
A.HA是一种弱酸
B.在M点,c(B-)=c(A-)
C.稀释前,c(HA)=10c(HB)
D.在M点,HA、HB溶液的导电性和电离程度都相同
7. 目前人类已发现的非金属元素除稀有气体外 , 共有 16 种 ,下列对这16种非金属元素的相关判断:
①都是主族元素 , 最外层电子数都大于4
②单质在反应中都只能作氧化剂
③氧化物常温下都是气态 , 所以又叫都气态氢化物
④氧化物常温下都可以与水反应生成酸
A. 有①②正确 B. 只有①③正确
C.只有③④正确 D. ①②③④均不正确
8.已知甲、乙溶质的质量分数与溶液密度的关系如下表所示:
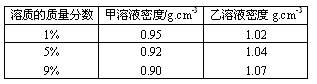
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合,下列叙述中,正确的是( )
A.混合后,甲、乙溶液中溶质的质量分数均大于5%
B.混合后,甲溶液中溶质的质量分数大于5%,乙溶液中溶质的质量分数小于5%
C.混合后,乙溶液中溶质的质量分数大于5%,甲溶液中溶质的质量分数小于5%
D.混合后,甲、乙溶液中溶质的质量分数均等于5%
9.下列两种溶液混合后,所得溶液中各离子浓度关系不正确的是:
A.0.1mol/L NaOH溶液与0.1mol/L CH3COOH溶液等体积混合
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.常温下,0.01mol/L NaOH溶液与pH=2CH3COOH溶液等体积混合
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.常温下,0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液混合后使pH=7
c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D.0.1mol/LCH3COOH溶液和0.1mol/LCH3COONa溶液等体积混合
c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
10.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去):
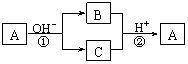 |
下列判断正确的是
A.X元素可能为Al B.X元素不一定为非金属元素
C.反应①和②互为可逆反应 D.反应①和②一定为氧化还原反应
 11. 下列关系图中,A是一种正盐 ,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C 外, 另一产物是盐酸盐。
11. 下列关系图中,A是一种正盐 ,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C 外, 另一产物是盐酸盐。
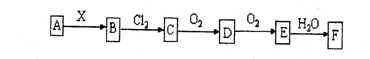
下列说法不正确的是:
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反
D.当X是强酸时,C在常温下是气态单质
12. 已知25℃、101kPa条件下:4Al(s)+3O2(g)==2Al2O3(s);△H=-2834.9kJ/mol
4Al(s)+2O3(g)==2Al2O3(s);△H=-3119.1kJ/mol由此得出的正确结论是
A.等质量的O2比O3能量低,由O2变O3为放热反应
B.等质量的O2比O3能量高,由O2变O3为吸热反应
C.O3比O2稳定,由O2变O3为放热反应
D.O2比O3稳定,由O2变O3为吸热反应
|
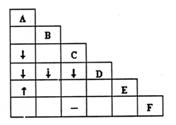
别它们,各取少量溶液进行两两混合,实验结果
如右表所示。表中“↓”表示生成沉淀,“↑”表
示生成气体,“-”表示观察不到明显现象,空格
表示实验未做。试推断其中F是
A.Na2CO3溶液 B.BaCl2溶液
C.MgSO4溶液 D.NaHCO3溶液
14.下列各项中的两个量,其比值一定为2 :1的是 ( )
A.在反应2FeCl3+Fe
3FeCl2中还原产物与氧化产物的质量
B.相同温度下,0.2mol/LCH3COOH溶液与0.1mol/LCH3COOH溶液中c(H+)
![]() C.在密闭容器中,N2+3H2 2NH3已达平衡时c(NH3)与c(N2)
C.在密闭容器中,N2+3H2 2NH3已达平衡时c(NH3)与c(N2)
D.液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液的体积
![]() 15.做实验时不小心粘了一些高锰酸钾,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液
15.做实验时不小心粘了一些高锰酸钾,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液
洗涤马上可以复原,其离子方程式为:MnO4—+C2O42—+H+→CO2↑+Mn2++ 。关
于此反应的叙述正确的是 ( )
A.该反应的氧化剂是C2O42— B.该反应右边方框内的产物是OH—
C.该反应电子转移总数是5e— D.配平该反应后,H+的系数是16
| X | ||||
| W | Y | R | ||
| Z | ||||
16、右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
A W、Y、Z元素的氢化物稳定性逐渐减弱
B. Z元素的最高氧化物对应的水化物的酸性最强
C. .Y元素的氢化物沸点比与其同族且原子序数小的元素的氢化物的沸点高
D X元素的非金属性比W元素的非金属性强
17、①氧化钠 ②氢氧化钠 ③过氧化钠 ④亚硫酸钠, 1mol上述固体物质长期放置于空气中,下列说法正确的是
A.上述物质都有发生了氧化还原反应
B.过氧化钠在反应中转移了2mol电子
C.质量增加的情况是①>③>④>②
D.质量增加的情况是②>①>③>④
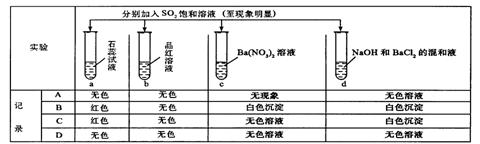
18.下列实验报告记录的实验现象正确的是
 |
19 .据2006年11月12日中央电视台每周质量报告报道,北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将“苏丹红Ⅳ号”列为三类致癌物,其初级代谢产物邻氨基偶氮甲苯和邻甲基苯胺均列为二类致癌物,对人可能致癌。
“苏丹红Ⅳ号”的结构式如下:
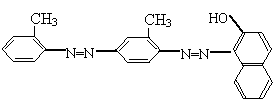 |
![]() 下列关于“苏丹红Ⅳ号”说法不正确的是
下列关于“苏丹红Ⅳ号”说法不正确的是
A、能发生加成反应 B、属于芳香烃衍生物
C、可以使酸性高锰酸钾溶液褪色 D、属于甲苯同系物
20.某烃有两种或两种以上的同分异构体,YC其同分异构体中的某一种的一氯代物只有一种,则这种烃可能是 ( )
①分子具有7个碳原子的芳香烃 ②分子中具有4个碳原子的烷烃
③分子中具有12个氢原子的烷烃 ④分子中具有8个碳原子的烷烃
A.①② B.②③ C.③④ D.②④
21.中秋佳节,市场上卖的无糖月饼满足了糖尿病患者的需求。这种月饼的甜味是由木糖醇作为蔗糖代替品的,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的优点。木糖醇是一种白色粉末状的结晶,分子式为C5H12O5,结构简式为:CH2OH(CHOH)3CH3OH,下列有关木糖醇的叙述中不正确的是 ( )
A.木糖醇是一种五元醇,不属于单糖
B.木糖醇可以与乙酸发生酯化反应
C.木糖醇与葡萄糖、果糖是同系物
D.木糖醇理论上可以分子内脱水生成环醚或烯烃
化学试题
第II 卷(非选择题 共49分)
二、(本题包括2个小题,共27分)
22 (12分)氢气在空气中燃烧生成水:2H2+O2=2H2O,这是人人皆知的常识,但有同学会提出:氢气在空气中燃烧会不会生成H2O2:H2+O2=H2O2?根据我们的经验,H2O2不稳定,即便是有少量H2O2生成,也会因火焰的高温而分解。某课外兴趣小组设计了如下图“验证H2在空气中燃烧的产物中是否含有H2O2”的实验装置。试填空:
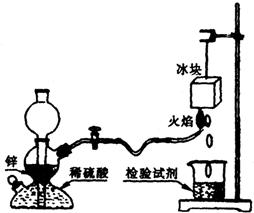
(1)甲同学从下列试剂中选择了一种检验试剂,成功检测到了H2O2的存在,该试剂
是______________ 。
A.淀粉溶液 B.氯化钠溶液
C.氢氧化钠溶液 D.淀粉碘化钾酸性溶液
甲同学检验时证明有H2O2产生的实验现象是__________________,冰块的作用是______________________。
(2)乙同学用较稀的酸性高锰酸钾溶液作为检验试剂,实验时观察到高锰酸钾溶液褪色(生成Mn2+),由此也证明了氢气燃烧有H2O2产生,写出该反应(高锰酸钾溶液褪色)的离子方程式:___________________。
(3)丙同学对乙同学的检验方案提出质疑;若锌粒中混有的杂质与稀硫酸反应有少量H2S或SO2等气体生成,也会使高锰酸钾溶液褪色,从而导致错误的判断。为消除丙同学的疑虑,请你提出对上述实验装置的改进建议:___________________________
23(15分)某温度时,在一个定容的密闭容器中加入3molA和1molB,发生如下反应:3A(g)+B(g)![]() xC(g)+yD(g),平衡时测得混合气体中D的体积分数为n%,如果现把0.6molA、0.2molB、0.8molC和wmol(w≤1.6)D气体,达到平衡时,D的体积分数仍为n%。
xC(g)+yD(g),平衡时测得混合气体中D的体积分数为n%,如果现把0.6molA、0.2molB、0.8molC和wmol(w≤1.6)D气体,达到平衡时,D的体积分数仍为n%。
(1)请将x、y、w可能的组合数据填入下表(不一定填满)
| 组号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| x | ||||||
| y | ||||||
| w |
 (2)若对(1)中的某一平衡体系,设法使容器体积减小(不断增大压强),结果发现,平衡先向正反应方向移动,后又向逆反应方向移动,则x、y可能的值是多少?说明后来平衡向逆反应方向移动的原因。
(2)若对(1)中的某一平衡体系,设法使容器体积减小(不断增大压强),结果发现,平衡先向正反应方向移动,后又向逆反应方向移动,则x、y可能的值是多少?说明后来平衡向逆反应方向移动的原因。
三、(本题包括1小题,共12分)
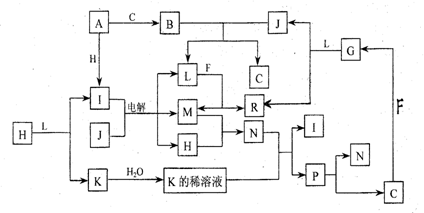
24. (12 分 ) 己知 : 下列各种物质都由短周期元素组成 , 它们之间的关系如下图所示。常温下 ,A 、 F 为金属单质 , F 既能与 L 溶液反应, 又能与 N 溶液反应。 C、 H 、 M 为气体单质 , 其中 H 呈黄绿色 ,A 、 B 、 I 、 K 、 L 、 R 的焰色反应均呈黄色。请回答 :
(l)p 的结构式为 ; B 的电子式为
(2)R水溶液呈碱性的原因可用离子方程式表示为
(3)还有一种物质能与B反应生成C.写出这个反应的化学方程式
(4)还有一种物质能与j反应生成C,写出这个反应的化学方程式
(5)某气体Q具有漂白作用,将Q与H等物质的量通入水中所得溶液没有漂白作用 ,写出发生的离子反应方程式
四.(本题包括1小题,共10分)
25.(10分) 齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”,因用价格不到“丙二醇”一半的“二甘醇”代替“丙二醇”作辅料,导致多名患者肾功能衰竭,药品安全问题再次引起人们的关注。 “丙二醇”是一种药用溶剂,而“二甘醇”则是工业用溶剂,有很强的毒性。“亮菌甲素” 为利胆解痉药,几乎不溶于水,辅料丙二醇溶成针剂用于临床。适用于急性胆囊炎、慢性胆囊炎急性发作等。
(1)二甘醇的结构简式是HO—CH2CH2—O—CH2CH2—OH。下列有关二甘醇的叙述正确的是_____________
A.不能发生消去反应 B.能发生取代反应
C.二甘醇可以由丙二醇制得 D.符合通式CnH2nO3
(2)“亮菌甲素”结构简式如图,
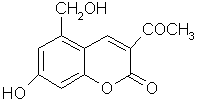
①写出“亮菌甲素”的分子式_______________________
②该物质每摩尔最多能和_______________mol H2发生加成.
③写出“亮菌甲素”和NaOH溶液完全反应化学反应式______________________
高三复习验收
化学试题参考答案
1.B 2B 3.B 4.D 5.D 6.B 7D .8.C 9.A 10.D 11.D 12.D 13.D 14.A 15.D 16.C 17.C 18.B 19.D 20.C 21.C
22.(1)D 淀粉碘化钾溶液变蓝 降温,防止H2O2分解
(2)2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
(3)用碱液洗气后,再检验H2O2
23、(1)①1,1,0.8 ②1,2,1.6 ③2,2,0.8 ④3,1,4/15 (2)x=1,y=1或2;可能是A液化或A、B均液化或A、B、C均液化或A、B、D均液化;
24. (1) H-O-Cl Na202的电子式 (2) AlO2-+ 2H20=Al(OH)3+OH_
(3) 2C02 + 2Na202 = 2Na2C03 + O2 (4) 2F2 + 2H20 = 4HF + O2
(5) S02 + Cl2 + 2H20 = 4H+ + 2Cl- + SO42-
25. (1)B、C
(2) ①C12H10O5 ② 5mol
③ 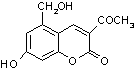 +3NaOH
+3NaOH ![]()
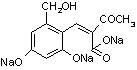 +2H2O
+2H2O