高三化学实验复习题
1.如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,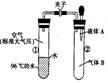 可发现试管①内的水立刻沸腾了。则液体A和气体B的组合一定不可能是下列的 ( )
可发现试管①内的水立刻沸腾了。则液体A和气体B的组合一定不可能是下列的 ( )
A.氢氧化钠溶液、二氧化碳B.水、氨气C.氢氧化钠溶液、一氧化氮 D.水、二氧化氮
2.当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色溶液中通入SO2气体,又生成了白色沉淀:将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的有 ( )
A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子
B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应
C.白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下发生了自身氧化还原反应
D.反应过程中消耗的SO2与生成的SO2的物质的量相等
3.化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
(1)下列关于实验的叙述正确的有 。
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
C.测量溶液的pH时,应先将PH试纸润湿
D.用溴水除去乙烯中混有的二氧化硫气体
E.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
F.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
(2)下列实验没有错误的是
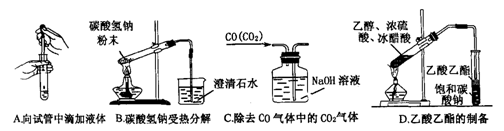
(3)下图为常见仪器的部分结构(有的仪器被放大)
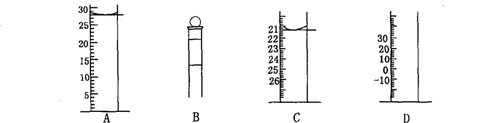
A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
答案:(1)A E (2)D (3)28.0 C
4.下列实验中所选用的仪器或结论不合理的是 BD
(填字母,多选扣分)
A.用托盘天平称量重11.7g氯化钠晶体
B.用碱式滴定管量取25.00mL溴水
C.不宜用瓷坩埚灼烧氢氧化钠、碳酸钠
D.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
E.用酸式滴定管量取浓硫酸配制一定浓度的稀硫酸时,某同学取前平视,取后俯视,所配硫酸的浓度偏高。
F. 把水滴加到脱脂棉包住的过氧化钠粉末上,脱脂棉可以燃烧,说明该反应为放热反应。
5.二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是氯气与硫合成二氯化硫的实验装置。
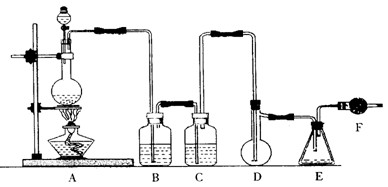 |
试回答下列问题:
(1)装置A中发生反应的化学方程式为 。
(2)装置B应盛放的药品是 ,C中是 。
(3)实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50—59℃.最好采用 方式加热。如何防止E中液体挥发 。
(5)F装置中干燥管内所盛物质是 ,作用是 。
|
![]() 答案:(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
答案:(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(2)饱和食盐水(或水) 浓硫酸
(3)增大反应接触面
(4)水浴 将锥形瓶放人冰水中冷却
(5)碱石灰(或固态氢氧化钠和生石灰);防止空气中水蒸气进入E中并吸收残留的氯气。
6.水中氧的含量测定步骤如下:
步骤1:水中的氧在碱性溶液中将Mn2+氧化为MnO(OH)2。
步骤2:加入碘离子将生成的MnO(OH)2再还原成Mn2+离子。
步骤3:用硫代硫酸钠标准溶液滴定步骤2中生成的碘。
有关的测定数据如下:
1:Na2S2O3溶液的标定。取25.00 mL KIO3标准溶液(KIO3浓度:174.8 mg·L-1)与过量KI在酸性介质中反应,用Na2S2O3溶液滴定,消耗12.45 mL。
2:取20.0℃下新鲜水样103.5mL,按上述测定步骤滴定,消耗Na2S2O3标准溶液11.80mL。已知该温度下水的饱和O2含量为9.08 mg·L-1。
3.在20.0℃下密闭放置5天的水样102.2mL,按上述测定步骤滴定,消耗硫代硫酸钠标准溶液6.75 mL。
1.写出上面3步所涉及的化学反应方程式。
2.计算标准溶液的浓度(单位mol·L-1)。
3.计算新鲜水样中氧的含量(单位mg·L-1)。
4.计算陈放水样中氧的含量(单位mg·L-1)。
5.以上测定结果说明水样具有什么性质?
答案:1.步骤1:2Mn2++O2+4OH-=2MnO(OH)2(1分)
步骤2:2I-+MnO(OH)2+4H+=Mn2++I2+3H2O(1分)
或3I-+MnO(OH)2+4H+=Mn2++I3-+3H2O
步骤3:I2+2S2O32-=2I-+S4O62-(1分)
或I3-+2S2O32-=3I-+S4O62-
2.标准溶液的浓度:9.841×10-3 mol·L-1
计算过程:
c(IO3-)=174.8×10-3g·L-1/214.0g·mol-1=8.168×10-4mol·L-1(1分)
c(S2O32–)=6×c(IO3–)×V(IO3-)/V(S2O32-)
=6×8.168×10-4mol·L-1×25.00mL/12.45mL=9.841×10-3mol·L-1(3分)
3.新鲜水样中氧的含量:8.98mg·L-1
计算过程:103.5mL水样中氧的含量:
n(O2)=0.25×c(S2O32-)×V(S2O32-)
=0.25×9.841×10-3mol·L -1×11.80×10-3L=2.903´10-5mol
氧含量:r(O2)=2.903×10-5mol×32.00×103mg·mol-1/103.5×10-3L
=8.98mg·L-1(3分)
注:新鲜水样的氧饱和度=(8.98/9.08)×100%=98.9%
4.陈放水样中氧的含量:5.20mg·L-1
计算过程:102.2mL中氧的含量:
n(O2)=0.25×c(S2O32-)×V(S2O32-)
=0.25×9.841×10-3mmol·mL-1×6.75mL=1.66×10-2mmol
氧含量:r(O2)=1.66×10-2mmol×32.00mg·mmol-1/102.2×10-3L=5.20mg·L-1
注:陈放引起氧的消耗量=8.98mg·L-1-5.20mg·L-1=3.78mg·L-1
7.某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)。
实验选用细铜丝、98.3%H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端浸入浓H2SO4中,另一端露置在液面上方。以下是该学习小组部分交流记录及后续探究实验的记录:
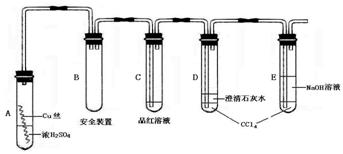 |
材料一:小组交流摘录
学生1:加热前,无现象发生;加热后,液面下的铜丝变黑,表面产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:,我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的无水CuSO4。
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色固体凝聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现:2Cu+S→Cu2S(黑色)。
材料二:探究实验剪辑
实验1:将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验2:截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色变浅了些,溶液呈蓝色。
实验3:将溶液过滤得黑色颗粒状物质,经稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少。
| |
(1)A试管上方的长导管的作用是 ;D、E两支试管中CCl4的作用是 。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式: 。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,并有大量气泡冒出,已知SO2难溶于CCl4中,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是: 。设计实验验证你的猜想 。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是 。(写化学式)
7.(1)冷凝、回流 防止倒吸
|
(3)由于SO2产生的快而多且溶解度较大。Ca(OH)2溶解度很小,生成了Ca(HSO3)2溶液的缘故。 取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成。(或者加热、加盐酸检验SO2气体等方法。)
(4)CuO、CuS、Cu2S
8.某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,实验作者设计这个实验的目的是
。
实验Ⅱ:取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为
。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
实验Ⅲ:换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ。实验Ⅱ、Ⅲ产生的现象完全相同。由上述实验得出的结论是 。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是 。从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
① ;
② 。
8.实验Ⅰ:检验Na2SO3是否变质(或检验Na2SO3溶液中是否混有Na2SO4)
实验Ⅱ:氢氧化铁胶体(或胶体) 先产生红褐色沉淀,后沉淀逐渐溶解,溶液变为黄色,有气泡产生 Fe3++3SCN-=Fe(SCN)3 Ba2++SO42-=BaSO4↓
实验III:Fe3+与SO32-同时发生氧化还原反应和双水解反应
2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑
①SO32-有较强的还原性,CO32-没有还原性 ②SO32-水解能力较CO32-小
9.某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答: (填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,反应的离子方程式为 。
(3)实验室溶解该熔融物,下列试剂中最好的是 (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
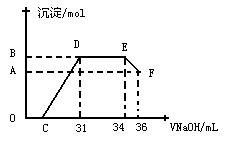 (1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
。
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 ;
上述现象说明溶液中 结合OH-的能力比 强(填离子符号)。
(3)B与A的差值为 mol。
(4)B点对应的沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为
mL
9.Ⅰ(1)合理 (2)NaOH溶液 2Al+2OH-+2H2O=2AlO2-+3H2↑ (3)B
Ⅱ(1)H++OH-=H2O (2)NH4++OH-=NH3·H2O Al3+、Fe3+、H+ NH4+
(3)0.008 (4)0.032 7
10、铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。
 某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
⑴ 试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
⑵ 加入试剂2后溶液中颜色由淡黄色转变为淡红色的是因为 ,请你运用物质结构的知识解释Fe3+比Fe2+稳定的原因 ;
⑶ 该同学猜想血红色溶液变为无色溶液液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要
作答) 。
10.⑴ 稀盐酸(1分) KSCN溶液(1分)
2Fe2++Cl2=2Fe3++2Cl-(1分) Fe3++SCN-=[Fe(SCN)]2(1分)+
⑵ 少量的Fe2+转化为Fe3+,加入KSCN后显红色(1分)
Fe3+的3d轨道填充了5个电子,为半充满状态(1分)
⑶ 不合理(1分) 我的猜想是[Fe(SCN)]2+配离子中的SCN-被过量的氯水氧化(1分)。设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)(2分)