高三化学考前训练基本理论(一)
第一部分回归课本
高一化学 绪言 化学——人类进步的关键
1、p1 超真空扫描遂道显微镜。1nm=_____m。
2、p2 化学史:1、原子分子学说,2、结晶牛胰岛素
3、p3 叶绿素分子的结构,所含元素的成分_______________________。
4、p4 太阳能促使燃料循环的构想图
5、p5 InP, 红色荧光体
第一章 化学反应及其能量变化
1、p19实验1-4
p20 燃料的充分燃烧
p20 化石燃料
p21 干馏煤气主要成分
p21 煤炭直接燃烧的缺点
2、p23三种能源时代,氢能源的优点
高三化学 第三单元 化学反应中的物质变化和能量变化
1. 变色溶液的原理[实验] P:28
2. 反应热与键能的关系P:35
3. 化学反应过程中能量变化示意图 P:36
4. 盖斯定律及其应用P:38
5. 燃烧热定义P:40
6. 中和热定义P:42
7. 中和热的测定[实验]:用品、步骤及误差分析 P:45
高一化学 第五章物质结构 元素周期律
1、电子云p89
2、原子结构模型的演变,p 93黑体:
道尔顿原子模型;汤姆生原子模型;卢瑟福原子模型;玻尔原子模型;电子云模型。
3、两性氧化物,两性氢氧化物p 99
4、锕系元素,镧系元素,这些元素均在 族。p 103
5、人体组织、体液中富集情况p 103
6、记住常见的几种同位素及用途:氧元素。其中818O作为 ;碳元素,其中6 12C作为 ;铀元素,其中92235U作为 ;氢元素,其中12H、
13H作为 。p 106
7、元素周期律,元素周期表的意义,寻找新物质p 107
8、1829年,“三素组”;1864年,《六元素表》;1865年,“八音律”,1869年,总结出元素周期律。 p 108
9、几种常见分子中的空间构型键角
水 ,甲烷 ,氨气 ,二氧化碳 ,白磷 。
高三化学
第二单元 胶体的性质及其应用
1、 氢氧化铁胶体的制取方法及化学反应方程式P15[实验2—1]、原理 P17
2、 淀粉胶体的提纯[实验2—3] P16 半透膜袋制成
3、 格雷哈姆首次提出胶体的概念
4、 渗析 P17 ,血液透析原理
5、 胶体的种类 P17
6、 胶体的性质 P19—20
7、 胶体的应用
8、 胶体的聚沉 P20
9、纳米材料 P22
高二化学 第四章第四节原电池
1、干电池是一次电池,主要工作原理:负极:Zn-2e-=Zn2+, P99
正极:2NH4++2e-=2NH3+H2
2、铅蓄电池是二次电池(可充电电池):工作原理:负极(Pb)Pb-2e-+SO42-=PbSO4
正极:(PbO2)PbO2+4H++SO42-+2e-= PbSO4+2H2O
3、锂电池不能用水作介质,可用有机碘化物作介质
4、燃料电池:能量利用率高,比燃料直接燃烧(发光发热)能量利用率高得多。
高三化学 第四单元 电解原理
1. 从组成、原理、功能几方面对电解池和原电池进行比较 P61
2. 铜的电解、精练 P52
3. 电镀及工艺改进 P54
4. 离子交换膜法制烧碱原理 P57
5. 如何精制食盐水 P57
6. 氯碱工业产品P59
基本理论(一)30分钟训练答案1AD2A3BD4D
5.(1)Al (1分) ; Cu片溶解,Al片附近产生红棕色气体,溶液变为蓝色(2分); Cu+4HN03(浓)=Cu(N03)2+2NO2↑+2H2O(2分);2H++NO3-+e-=N02↑+H20 (2分)
(2)Cu(1分);Al片溶解,Cu片附近产生红棕色气体(2分);AI+4HN03(稀)=AI(N03)3+NO↑+2H2O(2分); 4H++ NO3-+3e-=NO↑+2H2O(2分)
6.(1) ![]() Fe在周期表中位置略 (2分) (2) Be(OH)2 + 2NaOH
==Na2BeO2 +2H2O (2分) (3) 原子 30 (3分)
Fe在周期表中位置略 (2分) (2) Be(OH)2 + 2NaOH
==Na2BeO2 +2H2O (2分) (3) 原子 30 (3分)
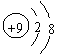 (4) H
(3分) CH4
或 NH3 (2分) (每空2分,共12分)
(4) H
(3分) CH4
或 NH3 (2分) (每空2分,共12分)
第二部分基本理论(一)30分钟定时测试
一、选择题(多选题)
1、1999年诺贝尔化学奖授予了开创“飞秒(10![]() s)化学”新领域的科学家,使运用激光光谱技术观测化学反应时分子中原子的运动成为可能。你认为该技术做不到的是 ( )
s)化学”新领域的科学家,使运用激光光谱技术观测化学反应时分子中原子的运动成为可能。你认为该技术做不到的是 ( )
A. 观察“电子云” B. 观察水电解生成氢气和氧气的过程
C. 分析酯化反应的断键方式 D. 观察钠原子变成钠离子的过程
2.下列各组离子中,在溶液中能够大量共存的一组是( )
A.A1O2—、SO42—、Cl—、K+ B.Al3+、Ca2+、HCO3—、Na+
C.Fe3+、NH4+、SO42—、SCN— D. H+、C1—、Na+、H PO42—
3.下列离子方程式书写正确的是( )
A.明矾溶液与氢氧化钡溶液反应,使SO42-恰好沉淀完全
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
B.硫化氢通入醋酸铅溶液中:Pb(Ac)2+H2S=2PbS↓+2HAc
C.在暂时硬度的硬水中,加入石灰水
Ca2++Mg2++2HCO3-+2OH-=CaCO3↓+MgCO3↓+2H2O
D.Fe3O4溶于氢碘酸溶液中 Fe3O4+8H++2I-=3Fe2++I2+4H2O
4、2005年10月17日凌晨4时33分,神舟六号飞船返回舱缓缓降落在内蒙古四子王旗主着陆场,我国首次多人多天的空间飞行试验取得圆满成功。从此向全世界宣告我国进入航天大国和航天强国。此次发射用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成氮气和水蒸气。已知:N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ•mol-1,N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534 kJ•mol-1。下列关于肼和二氧化氮反应的热化学方程式中,正确的是(D)
A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7kJ•mol-1
B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=+1135.7kJ•mol-1
C.N2H4(g)+NO2(g)=3/2N2(g)+2H2O(g);△H=-1135.7kJ•mol-1
D.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ•mol-1
二、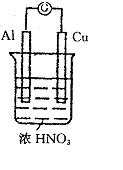 填空
填空
5.(14分)如图所示,将铝片铜片分别与灵敏电流计的两个接线柱相连,同时插入浓硝酸中,开始一段时间内,电流计指针偏向Al极,一段时间后,电流计指针偏向Cu极。
请回答下列问题
(1)开始一段时间内,正极是 ,装置内现象:
总化学方程式 。正极上电极反应式为
。
(2)一段时间后,正极是 ,装置内现象:
总化学方程式 。正极上电极反应式为
。
6.(12分)下表是元素周期表中的一部分。根据表中所列部分元素,回答有关问题。
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||||||||||||
| ⑧ | ⑨ | ⑩ | |||||||||||||||
(1) 载人航天器的宇航员活动仓内需要营造一种适合宇航员生存的人工生态环境,应该在元素⑥的一种常见的单质中充入一种气体且达到规定的比例,该气体分子的电子式是_______________。铁是航天器中用量较大的金属,请将铁元素符号填入上述周期表中。
(2) 已知某些不同族元素的性质有一定的相似性(所谓周期表对角线规则),写出与元素⑨对角的主族金属元素的氢氧化物与NaOH溶液反应的化学方程式________ __________________________。
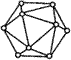 (3) 元素③的单质晶体熔点为2573K,沸点2823K,硬度大,则该晶体属于_________晶体。已知该晶体的基本结构单元是由该元素原子组成的正二十面体(如图所示),其中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个原子。通过观察图形及推算得出此基本结构单元中含有共价键数为__________。
(3) 元素③的单质晶体熔点为2573K,沸点2823K,硬度大,则该晶体属于_________晶体。已知该晶体的基本结构单元是由该元素原子组成的正二十面体(如图所示),其中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个原子。通过观察图形及推算得出此基本结构单元中含有共价键数为__________。
(4) A、B、C、D是上述①—⑩中的四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙分子含有相同数目的质子,则A元素是_________(填序号)。除A分别与B、C、D结合生成甲、乙、丙化合物外,C和D也可结合生成化合物丁。B、C、D三种元素的单质和甲、乙、丙、丁四种化合物可以相互转化:B(单质)+乙→ C(单质)+甲;C(单质)+丙→ 乙+丁。则B的原子结构简图为____________,丙的化学式为______________。