高三化学考前指导
组卷:南安一中高三化学备课组
班级 姓名 号数
一、选择题
1.向10mL 0.1mol/L的CuSO4溶液中加入10mL 0.15mol/L的NaOH溶液时,生成一种蓝色沉淀,溶液中的铜离子几乎沉淀完全,该蓝色沉淀的主要成分是 ( )
A.Cu(OH)2 B.Cu2(OH)2SO4
C.3Cu(OH)2·CuSO4 D.Cu2(OH)2
2.超导材料YBa2Cu3Ox中Y为+3价,Ba为+2价,Cu为+2、+3混合价态,其中+2价的Cu与+3价的Cu的物质的量之比为18∶7,则x的值为( )
A. 6.50 B. 6.92 C. 8.00 D. 8.05
3.将50.00mL 0.098mol/L的羟氨(NH2OH)酸性溶液,与足量硫酸铁在煮沸条件下反应,生成的Fe2+又恰好被49.00mL0.040mol/L的酸性高锰酸钾溶液所氧化。在上述反应中,羟氨的氧化产物为( )
A.NO2 B.NO C.N2O D.N2
4、在3Cl2+6KOH
![]() KClO3+5KCl+3H2O中,下列说法不正确的是
KClO3+5KCl+3H2O中,下列说法不正确的是
①Cl2是氧化剂,KOH是还原剂②KCl是还原产物,KClO3是氧化产物③反应中每3个Cl2分子中有5个电子转移④被氧化的氯原子是被还原氯原子物质的量的5倍⑤被还原的氯原子的物质的量是被氧化的氯原子的物质的量的5倍。
A.①④
B.③④ C.①⑤ D.②③
5、用下列方法均可制得氧气
(1)2KClO3
![]() 2KCl+3O2↑ (2)2Na2O2+2H2O=4NaOH+O2↑
2KCl+3O2↑ (2)2Na2O2+2H2O=4NaOH+O2↑
(3)2HgO ![]() 2Hg+O2↑ (4)2KMnO4
2Hg+O2↑ (4)2KMnO4 ![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为
A. 3:2:1:4 B. 1:1:1:1 C. 2:1:2:2
D. 1:2:1:1
6.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
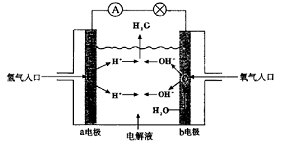
A.a电极是负极
B.b电极的电极反应为:4OH- — 4e-=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
二、非选择题
7、在盛有淀粉NaI的溶液中,滴加少量的NaClO溶液,立即看到溶液变蓝,这是因为_________________的缘故,相应的反应方程式为_________________________________________________(提示:NaClO被还原成Cl2);在盛有淀粉和碘所形成的蓝色溶液中,滴加Na2SO3溶液时,又发现蓝色逐渐消失,这是因为________________________________________的缘故,相应的反应方程式为________________________________________。对比以上两组实验所得结果,得出NaClO、I2和Na2SO3的氧化性由强到弱的顺序是______________________________。
8、(1)今年5月底6月初,各地报纸纷纷转载了不要将不同品牌洁污剂混合使用的警告,据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。根据你的化学知识作出如下判断(这一判断的正确性有待证明):当事人使用的液态洁污剂之一必定含有氯,最可能的存在形式是 和
。当另一种具有 (性质)的液态洁污剂与之混合,可能发生如下反应而产生氯气:
(2)“神舟四号”模拟载人飞船于2002年12月30日在酒泉载人航天发射场发射升空,按预定轨道在太空环绕地球飞行107圈,于2003年1月5日在内蒙古地区对飞船进行了成功回收。回答下列问题:
①有一种火箭推进器中盛有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合反应时生成无污染的物质并放出大量的热,从而产生巨大的推动力。写出该反应的化学方程式:
.
②在宇宙气飞船中,一般要安装盛有Na2O2颗粒的装置,用来提供氧气,若用KO2(超氧化钾)代替,效果更佳。写出在飞船舱内用生成氧气的化学方程式:
,该反应中氧化剂与还原剂的物质的量之比为
,电子转移的数目为
。
9.已知:C(s)+O2(g)===CO2(g);△H=-393.5KJ/mol
2 CO(g)+O2(g)===2CO2(g);△H=-567KJ/mol
写出C(s)+O2(g)→CO(g)的热化学方程式
10.合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气中的CO,其反应式为:(Ac表示醋酸根) [Cu(NH3)2Ac]+CO+NH3
![]() [Cu(NH3)3]Ac·CO;△H<0
[Cu(NH3)3]Ac·CO;△H<0
(1) 必须除去原料气中CO的原因是
。
(2) 醋酸二氨合铜(Ⅰ)吸收CO的生产适宜条件应是
。
(3) 吸收CO后的醋酸铜氨溶液经过适当处理又可再生,恢复其吸收CO的能力以供循环使用。醋酸铜氨溶液再生的生产适宜条件是
。
11. 在一定温度下,有1mol N2气体和3mol H2气体发生下列反应:
N2(g)+3H2(g) ![]() 2NH3(g)
; △H<0
2NH3(g)
; △H<0
(1)若在相同温度下,分别在1L定压密闭容器中和1L定容容器中反应(密闭):
哪个容器中的反应先达到平衡? 答:
哪个容器中的N2的转化率高? 答:
(2)若在上述定压密闭容器中,反应已达到平衡时,再加入0.5摩氩气,则N2的转化率会起什么变化?正反应速度与原平衡相比,有无变化,简答理由。
(3)若在1升定容容器中,上述反应达到平衡时,平衡混和物中N2、H2、NH3的物质的量分别为A、B、C摩。仍维持原温度,用x、y、z分别表示开始时N2、H2、NH3的加入量(mol),使达到平衡后N2、H2、NH3的物质的量也为A、B、C摩。则应满足的条件是:
①若x=0,y=0,则z=
②若x=0.75,则y应为
mol、z应为
mol。
③x、y、z应满足的一般条件是
12. 剪长约6cm、宽2cm的铜片、铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2cm)。将铜片与铝片分别和电流表的“+”、“-”端相连接,电流表指针调到中间位置。取两个50mL的小烧杯,在一个烧杯中注入约40mL的浓硝酸,在另一只烧杯中注入40mL0.5mol/L的硫酸溶液。试回答下列问题:
(1)两电极同时插入稀硫酸中,电流表指针偏向 (填“铝”或“铜”)极,铝片上电极反应式为 ;
(2)两电极同时插入浓硝酸时,电流表指针偏向 (填“铝”或“铜”)极,此时铝是 (填“正”或“负”)极,铝片上电极反应式为 。
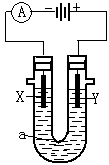 13.电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两电极板,通过导线与直流电源相连。回答以下问题:
13.电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两电极板,通过导线与直流电源相连。回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X的电极材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
14、已知气体R不会与水反应,且密度比空气小。某学生为验证气体R的性质并测定R的相对分子质量,设计如下实验:
①组装装置A,并检查该装置的气密性。
②将胶头滴管吸入少量的水,重新组装好装置A,并准确称量装置A,得到质量m1 g;
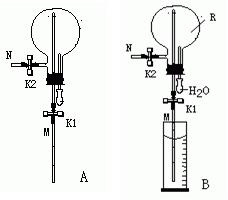 ③用装置A收集气体R。收集气体R后,准确称量装置A,得到质量为m2 g;
③用装置A收集气体R。收集气体R后,准确称量装置A,得到质量为m2 g;
④取一定体积的量筒,装入足量的水,并滴入2-3滴酚酞试剂。将装置A的长导管N插入量筒的水中,组装成装置B,此时量筒中液体凹液面读数为V1 mL。
⑤打开止水夹K1,挤压胶头滴管使其中的水进入烧瓶。立即看到红色的“喷泉”形成。当“喷泉”现象不再产生时,量筒中液体凹液面读数为V2 mL。
已知:实验时的温度T(K)、压强p(kPa)、空气的平均分子质量为29.0、空气的密度为ρ(g/L)。回答下列问题:
(1)通过该实验,可以推知气体R具有的性质有:___________________________________________________________________________________________________________。
(2)测定R相对分子质量实验所依据的原理是:__________________________________________________________________________________________________________。
(3)如何检查装置A的气密性?答:______________________________________________________________________________________________________________________。
(4)用装置A收集气体R时,气体R应该从_____导气管进(填“M”或“N”),从另一导气管出。
(5)由实验测得R的相对分子质量为___________________________________。
(6)如果步骤③收集R气体时,烧瓶中还有部分空气,导致步骤⑤形成“喷泉”时,液体没有充满整个烧瓶,对气体R相对分子质量的测定是否有影响?答:__________(“有”或“没有”)。原因是:________________________________________________。
答案
1-6 C B C C C B
7、 I-被氧化成I2
2NaI+2NaClO+2H2O==I2+Cl2+4NaOH I2被还原成I- H2O+I2+Na2SO3==
2HI+Na2SO4 NaClO>I2>Na2SO3
(每线1分)
8、 (1)Cl-和ClO-(2分);酸;Cl-+ClO-+2H+=Cl2+H2O
(2) N2H4+2H2O2=N2+4H2O; 4KO2+2CO2=2K2CO3+3O2;1:3;3e-
9. C(s)+![]() O2(g)→CO(g)
; △H=-110.5KJ/mol
O2(g)→CO(g)
; △H=-110.5KJ/mol
10、 (1)防止催化剂中毒 (2)低温、高压 (3)高温、低压
11、(1)定压容器、定压容器(2)A2的转化率以及正反应速度都降低。理由是:由于反应容器保持定压,所以当加入氩气后,反应容器的容积会增大,为样使得反应容器中的各物质的浓度降低,所以正反应速度降低(逆反应速度也降低),从反应物及产物的系数可以看出,反应物的系数比产物的系数大,所以,容器容积增大对正反应速度降低的效果更为明显,故平衡向逆反应方向移动,使A2的转化率降低(3)①2②2.25 0.5③3x=y 2x+z=2(其它合理答案都正确)
12、[解析]电极的确定依赖于具体的电极反应,在这个问题上,学生易受思维定势的影响,以为金属越活泼,便一定是负极,殊不知,在浓硝酸中,Al表面产生了钝化,发生反应的是Cu。因此,当Al、Cu同时插入稀硫酸时,电流表指针偏向Al。(电流方向从正极到负极)。电极反应式为:Al-3e-=Al3+。而当Al、Cu同时插入浓硝酸时,电流表指针偏向Cu,Al作正极,且电极反应式为:NO3-+4H++3e-=NO+2H2O。
13、解析:(1)①2H++2e-=H2↑ 放出气体,溶液变红。
②2Cl--2e-=Cl2↑ 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。
(2)①纯铜 Cu2++2e-=Cu ②粗铜 Cu-2e-=Cu2+
14、(1)R极易溶于水;R水溶液显碱性。
(2)根据阿伏加德罗定律推论可知,同温、同压下,两种同体积的不同气体的质量之比等于它们的相对分子质量之比。
(3)关闭K2,打开K1,并将导管M插入水中,用手握住烧瓶,如果有气泡产生,并在松开手时,导管M将形成一段水柱,说明气密性好。(本题有很多方法,只要合理均可以给分)
(4)M
(5)MR=29×[1-(m1-m2)×103/ρ(V1-V2)]
(6)没有(1分);(V1-V2)的改变将同等程度的引起(m1-m2)改变