高三化学科综合练习(六)
(满分108分 考试时间60分钟)
班级_________ 座号_______ 姓名____________ 成绩___________
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5
将选择题答案填入下表中:
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 |
第I卷(单项选择题 6分×8=48分)
6.我国赢得了2008年第29届夏季奥运会的举办权,为向世界展现中国的新形象,某校学生提出下列建议,你认为不可以采纳的是【 】
A.分类回收垃圾
B.开发新能源,减少化石燃料的燃烧
C.大型庆典活动时,用数万只氢气气球腾空而起,以增添活动气氛
D.开发、生产无汞电池
7.下列实验操作不正确的是【 】
A.将汽油放在带橡皮塞的玻璃瓶中
B.做过碘升华实验的烧杯用酒精洗涤
C.做过银镜反应实验的试管用稀硝酸洗涤
D.酸碱中和滴定实验中,锥形瓶用蒸馏水润洗后,即可注入待测液
8.下列离子方程式正确的是【 】
A.氯气和水反应:Cl2+H2O=2H++Cl-+ClO-
B.钠投入水中:Na+2H2O=Na++2OH-+H2↑
C.硝酸铝溶液中加入过量氨水:A13++3NH3·H2O=A1(OH)3↓+3NH4+
D.氢氧化钡溶液中加入少量碳酸氢钠溶液:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O
9.![]() 代表阿伏加德罗常数值,下列说法正确的是【 】
代表阿伏加德罗常数值,下列说法正确的是【 】
A.9g重水所含有的电子数为![]()
B.1mol MgCl2中含有离子数为![]()
C.7.1g氯气与足量NaOH溶液反应转移的电子数为![]()
D.1molC10H20分子中共价键总数为![]()
10.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象【 】
A.![]()
![]()
![]()
B.![]()
![]()
![]()
C.元素周期表中VA族所有元素的原子
D.元素周期表中第1周期所有元素的原子
11.仅用一种试剂鉴别如下物质:苯、![]() 、
、![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,下列
溶液,下列
试剂中不能选用的是【 】
A. 溴水 B.
![]() 溶液
C. 酸性
溶液
C. 酸性![]() 溶液 D.
溶液 D. ![]() 溶液
溶液
12.下列混合溶液中,各离子浓度的大小顺序正确的是【 】
A. ![]() 氨水与
氨水与![]() 盐酸混合,
盐酸混合,
![]()
B. ![]()
![]() 溶液与
溶液与![]()
![]() 溶液混合,
溶液混合,
![]()
C. ![]() 溶液与
溶液与![]() 溶液混合,
溶液混合,
![]()
D.![]() 溶液与
溶液与![]() 盐酸混合,
盐酸混合,
![]()
13.充分煅烧黄铁矿Wg,反应完全后冷却至室温,称得固体物质的质量是mg,生成SO2为VL,则黄铁矿中FeS2的质量分数是(假设矿石中的杂质受热不分解,也不会与SO2反应)【 】
A.60V/22.4W B.22.4V/60W C.80V/22.4W D.3(W-m)/W
第Ⅱ卷(非选择题 共60分)
26.(13分)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成![]() 。
。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式 。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 。
。
27.(9分)A、B、C、D是短周期的四种元素,其原子序数依次增大。已知A、D同主族,C、D同周期,A原子L层电子数是K层电子数的2倍,B原子最外层有6个电子,且A原子和D原子的最外层电子数之和等于B原子和C原子的最外层电子数之和。请用化学用语回答以下问题:
(1)A、D两种元素分别是 、 。(写元素符号)
(2)A、B、C、D原子半径由小到大的顺序 。
(3)写出由上述元素组成的单质化合物之间相互作用发生置换反应的一个化学方式:
。
(4)B和C两元素组成的化合物在固态时属于 晶体(填晶体的类型),其电子式
为 。
28.(19分)烯烃通过臭氧化并经锌和水处理得到醛或酮。例如:
![]()
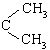
![]()
![]()
![]()

I. 已知丙醛的燃烧热为![]() ,丙酮的燃烧热为
,丙酮的燃烧热为![]() ,试写出丙醛燃烧的热
,试写出丙醛燃烧的热
化学方程式 。
II. 上述反应可用来推断烯烃的结构。一种链状单烯烃A通过臭氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应,催化加氢生成D。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。反应图示如下:
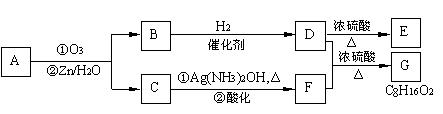
回答下列问题:
(1)B的相对分子质量是
;C![]() F的反应类型为
;D中含有官能团的名称
。
F的反应类型为
;D中含有官能团的名称
。
(2)![]() 的化学方程式是:
的化学方程式是:
。
(3)A的结构简式为 。
(4)化合物A的某种同分异构体通过臭氧化并经锌和水处理只得到一种产物,符合该条件的异构体的结构简式有 种。
28.(19分)
I. 合成氨工业对化学的国防工业具有重要意义。写出氨的两种重要用途 、
。
II. 实验室制备氨气,下列方法中适宜选用的是 。
① 固态氯化铵加热分解 ② 固体氢氧化钠中滴加浓氨水
③ 氯化铵溶液与氢氧化钠溶液共热 ④ 固态氯化铵与氢氧化钙混合加热
III. 为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。
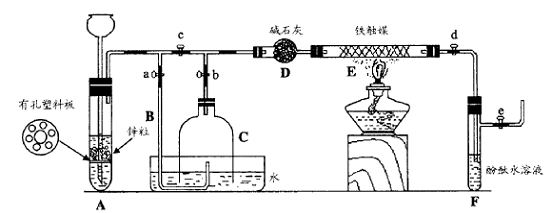
[实验操作]
① 检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气并检验其纯度。
② 关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③ 用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是 。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是 ,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是 ,C瓶内气体的成份是 。
(3)在步骤③中,先加热铁触媒的原因是 。
反应管E中发生反应的化学方程式是 。
高三化学科综合练习(六)参考答案
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | C | A | C | D | C | D | B | D |
26.(13分) (1)![]() [或
[或![]() ]
]
(2)![]()
![]()
[或![]()
![]() ]
]
(3)①③④ (4)![]()
可溶性锌盐与氨水反应产生的![]() 可溶于过量氨水中,生成
可溶于过量氨水中,生成![]() ,氨水的用量不易控制
,氨水的用量不易控制
27.(9分)
(1)C,Si (各1分,共2分)
(2)O<C<Si<Mg;(2分)
(3)2Mg+CO2=2MgO+C;(或2C+SiO2=Si+2CO或Mg+SiO2=2MgO+Si)(2分)
(4)离子(1分),Mg2+[:O:]2- (2分)
28.(19分)I. ![]()
![]() ;
;![]()
II. (1)86 氧化反应 羟基
(2)![]()
![]()
![]()
(3)![]() (4)3
(4)3
29.(19分)
I. 制化肥、制硝酸
II. ②④
III. (1)排除空气,保证安全
(2)锌粒与酸脱离 尽量增大氢气的浓度以提高氮气的转化率 N2 H2
(3)铁触媒在较高温度时活性增大,加快氨合成的反应速率
![]()
![]()
![]()
高三化学科综合练习(六)参考答案
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | C | A | C | D | C | D | B | D |
26.(13分) (1)![]() [或
[或![]() ]
]
(2)![]()
![]()
[或![]()
![]() ]
]
(3)①③④ (4)![]()
可溶性锌盐与氨水反应产生的![]() 可溶于过量氨水中,生成
可溶于过量氨水中,生成![]() ,氨水的用量不易控制
,氨水的用量不易控制
27.(9分)
(1)C,Si (各1分,共2分)
(2)O<C<Si<Mg;(2分)
(3)2Mg+CO2=2MgO+C;(或2C+SiO2=Si+2CO或Mg+SiO2=2MgO+Si)(2分)
(4)离子(1分),Mg2+[:O:]2- (2分)
28.(19分)I. ![]()
![]() ;
;![]()
II. (1)86 氧化反应 羟基
(2)![]()
![]()
![]()
(3)![]() (4)3
(4)3
29.(19分)
I. 制化肥、制硝酸
II. ②④
III. (1)排除空气,保证安全
(2)锌粒与酸脱离 尽量增大氢气的浓度以提高氮气的转化率 N2 H2
(3)铁触媒在较高温度时活性增大,加快氨合成的反应速率
![]()
![]()
![]()