高三化学科综合练习(五)
(满分108分 考试时间60分钟)
班级_________ 座号_______ 姓名____________ 成绩___________
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Fe 56
将选择题答案填入下表中:
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 |
第I卷(单项选择题 6分×8=48分)
6、2005年11月,中石油吉林石化公司双苯厂发生爆炸,引发松花江水环境污染。已知主要污染物为苯、苯胺(C6H5NH2)和硝基苯等,为了净化水质,在取水口投放活性炭,下列有关说法不正确的是【 】
A.苯燃烧时产生明亮的带有浓烟的火焰
B.硝基苯不属于芳香烃
C.利用活性炭净化水质的过程是化学变化
D.硝基苯是带有苦杏仁味的油状液体,密度大于水,在水中具有极高的稳定性
7、用惰性电极电解一定浓度的下列物质的水溶液,电解结束后,向剩余电解液中加适量水,能使溶液与电解前相同的是【 】
A.CuCl2 B.NaOH C.CuSO4 D.NaCl
8、某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色会逐渐褪色;③将镁粉放入液溴中.未观察到任何明显现象;④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是【 】
A.镁粉只直接与溴水中的溴反应
B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到
D.镁粉在水的催化下与溴发生反应
![]() 9、合成氨的反应为:N2(g)+3H2(g)
2NH3(g);△H<0
9、合成氨的反应为:N2(g)+3H2(g)
2NH3(g);△H<0
下列有关说法正确的是【 】
①反应开始时氮气、氢气浓度分别为1 mol/L、3 mol/L,没有氨气,平衡时各物质的浓度
比c(N2)∶c(H2)∶c(NH3)可能为1∶3∶2
②使用铁触媒作催化剂能提高合成氨的经济效益
③合成原料来源:分离空气制得氮气,电解水可制得氢气
④因为正反应放热,所以工业上应采用低温合成
⑤升高温度,逆反应速率增大,正反应速率减小,所以平衡向逆反应方向移动
⑥在一定条件下,当生成氨气的速率和生成氮气的速率相等时,反应达到平衡状态
⑦增加氮气量可以提高氢气的转化率,氮气本身的转化率会降低
⑧压强越大越有利于合成氨,所以工业合成氨压强越大越好
A.①⑤⑥ B.②③⑦ C.①②⑦ D.③④⑧
10、在 20mLpH=2的醋酸溶液中,加入VmLpH=12的NaOH溶液。下列说法正确的是【 】
A.如果V=20,则所得混合溶液的![]() 大于7
大于7
B.当V=20时,混合溶液中离子浓度大小关系为c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.如果所得混合溶液的![]() =7,则V小于20
=7,则V小于20
D.所得混合溶液中一定存在c(Na+)+c(H+)= c(CH3COO-)+c(OH-)
11、下列说法正确的是【 】
A.1mol铜与足量硫充分反应生成物质的物质的量为1mol
B.常温常压下,31g白磷分子中的共价键数为6NA
C.可以利用下面反应设计原电池 H2SO4(aq)+BaCl2(aq)==2HCl(aq)+BaSO4(s);ΔH<0
D.常温下,NH4+、Ca2+、C1—、K+能在c(H+)/c(OH-)==1×1013的溶液中共存
12、“类推”是思维的一种形式,但往往也有不对的,下列“类推”中正确的是【 】
A.Fe、Cu连接插在稀硫酸中形成的原电池,Fe为负极;那么Fe、Cu连接插在浓硝酸溶液中形成的原电池,Fe也为负极
B.HBr的沸点比HCl高,那么HCl的沸点比HF高
C.C2H5Br可以发生消去反应,那么(CH3)3CBr也可以发生消去反应
D.麦芽糖可以水解为两分子葡萄糖,那么蔗糖也可以水解为两分子葡萄糖
13、在一定温度时将x克某物质A完全溶解于50克水中,若将所得的溶液蒸发掉20克水后并恢复至原来温度,可析出A物质a克,再蒸发掉10克水后仍恢复至原温度,又析出A物质b克,最后将剩余溶液蒸干,得到A物质y克。若A物质不含结晶水,则x与y的比值为【 】
A.(a+3b)/3b tx B.(a+4b)/4b
C.(a+3b)/2b D.(a+4b)/3b
第Ⅱ卷(非选择题 共60分)
26、(本题共12分)
(1)中学化学常见的淡黄色化合物A可以和水反应生成氧气,在A和水的反应中还原剂是 (写化学式),1molA参加反应转移的电子数是 NA,物质A中阳离子数和阴离子数之比为 。
(2)短周期元素B的原子最外层电子数等于最内层电子数,次外层电子数是最外层电子数的4倍,请问B在周期表中的位置是 。
(3)要通过洗气瓶除去SO2中混有的SO3,洗气瓶中的液体是 ;可以用来鉴别SO2和CO2的试剂是 。
27、(本题共16分)
B是一种人体不可缺少的无色无味的液体;C是一种有磁性的化合物;E是一种无色、无味的有毒气体,根据下列关系图,完成本题:
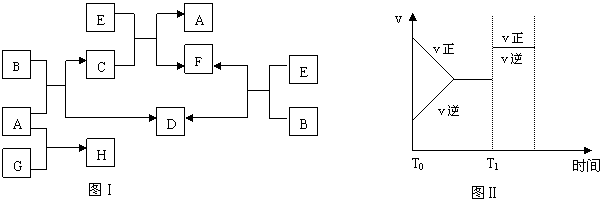 (1)写出B、C的化学式:B
,C
。
(1)写出B、C的化学式:B
,C
。
(2)E和N2结构相似,请写出E的电子式:E 。
![]() (3)在101 kpa和150℃时,可逆反应E+B F+D反应速率和时间的关系如图Ⅱ所示,那么在T1时速率发生改变的原因可能是:
(填选项)。
(3)在101 kpa和150℃时,可逆反应E+B F+D反应速率和时间的关系如图Ⅱ所示,那么在T1时速率发生改变的原因可能是:
(填选项)。
A、升高温度 B、增大压强 C、加入催化剂
(4)若G是一种淡黄色固体单质,16克的G和足量的A反应放出的热量为Q kJ(Q>0),写出这个反应的热化学方程式: 。
若G是一种气态单质,H的水溶液可以和有机物I反应使溶液呈紫色,请写出G、I的分子式: , ;
H的水溶液呈酸性,请用化学方程式表示呈酸性的原因: 。
28.(16分)
阅读以下信息:
1.和官能团相连的碳原子通常称为α-C,该碳原子上的H则称为α-H,受羰基的影响,含羰基化合物的分子中的α-H活泼性较强。
2.2004年是俄国化学家马科尼可夫近世100周年。他因提出碳碳双键和HX加成时,X原子加在含氢原子个数少的碳原子上的加成规则而著称于世。
3.丙烯有下列反应关系:
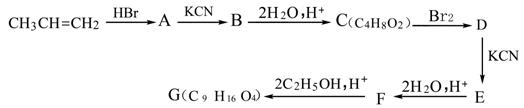
回答下列问题:
(1)写出下列符号所表示物质的结构简式:
A__________________________、B___________________________、
D__________________________、G___________________________。
(2)写出B→C的化学反应方程式_______________________________________________。
(3)以上A→B的反应属于 反应 。
(4)系统命名时,如果有不含碳原子的取代基,一般将其写在含碳原子取代基的前面并标明位置。请给出D的系统命名 。
(5)符合C的分子式且属于酯类的同分异构体有_________种。
29、(本题共16分)
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程(反应缓和,不发生爆炸),其设计的模拟装置如下:
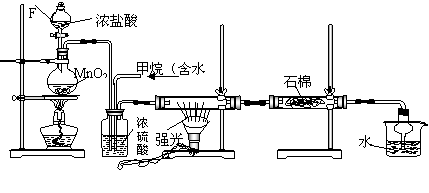
A B C D E
根据要求填空:
(1)玻璃仪器F的名称: ;
A中发生的反应的离子方程式: 。
(2)B装置有三种功能:①控制气流速度;②均匀混合气体;③ 。
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 ;
(4)为了除去多余的氯气,D装置的石棉中均匀混有KI粉末,请问能否换成碱石灰 (能、不能);
(5)E装置的作用是 (填编号)
A、收集气体 B、吸收氯气 C、防止倒吸 D、吸收氯化氢
E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 ;
高三化学科综合练习(五)参考答案
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | C | B | D | C | D | D | C | C |
26、(每空2分,12分)
(1)Na2O2, 1, 2:1
(2)第三周期第ⅡA族
(3)98%浓硫酸,品红或酸性高锰酸钾。(合理答案都可以)
27、(每空2分,16分)
(1)H2O Fe3O4
![]() (2) C O
(2) C O
(3)BC(单选给1分,错选不给分)
(4)S(s)+Fe(s)=FeS(s); △H=-2Q kJ·mol-1(方程式要求全对才给分)
![]() Cl2,C6H6O;FeCl3+3H2O Fe(OH)3+3HCl(方程式要求全对才给分)
Cl2,C6H6O;FeCl3+3H2O Fe(OH)3+3HCl(方程式要求全对才给分)
28、(16分)
(1)
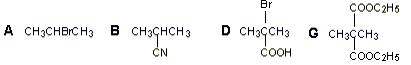
(2)
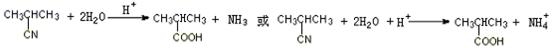
(3)取代;(2)2-溴-2-甲基丙酸;(5)4 (以上每空2分)
29、(16分)
(1)分液漏斗(2分)
MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O(方程式要求全对才给分)(3分)
Mn2++Cl2↑+2H2O(方程式要求全对才给分)(3分)
(2)除去甲烷中的水(2分)
|
(3)CH4+2Cl2=C+4HCl (3分)
(4)不能 (2分)
(5)CD(单选给1分,错选不给分,共2分),分液(2分)
高三化学科综合练习(五)参考答案
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | C | B | D | C | D | D | C | C |
26、(每空2分,12分)
(1)Na2O2, 1, 2:1
(2)第三周期第ⅡA族
(3)98%浓硫酸,品红或酸性高锰酸钾。(合理答案都可以)
27、(每空2分,16分)
(1)H2O Fe3O4
![]() (2) C O
(2) C O
(3)BC(单选给1分,错选不给分)
(4)S(s)+Fe(s)=FeS(s); △H=-2Q kJ·mol-1(方程式要求全对才给分)
![]() Cl2,C6H6O;FeCl3+3H2O Fe(OH)3+3HCl(方程式要求全对才给分)
Cl2,C6H6O;FeCl3+3H2O Fe(OH)3+3HCl(方程式要求全对才给分)
28、(16分)
(1)

(2)
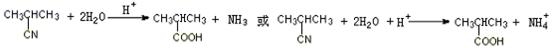
(3)取代;(2)2-溴-2-甲基丙酸;(5)4 (以上每空2分)
29、(16分)
(1)分液漏斗(2分)
MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O(方程式要求全对才给分)(3分)
Mn2++Cl2↑+2H2O(方程式要求全对才给分)(3分)
(2)除去甲烷中的水(2分)
|
(3)CH4+2Cl2=C+4HCl (3分)
(4)不能 (2分)
(5)CD(单选给1分,错选不给分,共2分),分液(2分)