高三化学期中考试综合练习(金属部分)
班级 姓名 学号
1.钠盐和钾盐性质相似,但在实际生产中多用钾盐而不用钠盐。如在实验室制氧气是用KClO3而不是用NaClO3,制黑火药用KNO3而不用NaNO3,并且在KNO3中不能含有NaNO3。对上述现象,以下解释合理的是
A.钠盐比钾盐更容易得到 B.钾盐的氧化性比钠盐弱
C.钾盐的熔点比钠盐高 D.钠盐的吸湿性比钾盐强
2. 将镁在空气中燃烧的全部产物溶解在80mL浓度为2.375mol·L-1盐酸中,用40mL0.9 mol·L-1氢氧化钠溶液中和多余盐酸,然后在此溶液中再加入过量的氢氧化钠溶液,把生成的NH3全部用足量的盐酸吸收,经测定氨为0.646g,则燃烧掉镁的质量为(已知Mg3N2与盐酸反应生成MgCl2和NH4Cl)
A. 1.392g B. 2.59g C. 3.46g D. 1.68g
3. MgCl2和NaHCO3按物质的量之比1:2混合制成溶液,加热蒸干得到的固体是
A. Mg(HCO3)2和NaCl B. Mg(OH)2和NaCl
C. MgCl2和Na2CO3 D. MgCO3和NaCl
4. 甲、乙两烧杯中各盛有100mL3 mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙 = 1:2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.8g
5.下列反应的离子方程式正确的是
A.向苯酚钠溶液中通入少量二氧化碳:CO2+H2O+2C6H5O—→2C6H5OH+CO32-
B.向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH—=A1O2—+2H2O
C.硫酸亚铁溶液中加入酸化的双氧水:Fe2++2H++H2O2=Fe3++2H2O
D.将少量硝酸银溶液滴入氨水中:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
6.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL l moL/L的盐酸;恰好使混合物完全溶解并放出标准状况下224mL气体。向所得溶液中加入KSCN溶液无血红色出现,若用足量的CO在高温下还原相同质量的此混合物,能得到单质铁的质量为
A.11.2g B.2.8g C.5.6g D.无法计算
7.把铝粉和某铁氧化物xFeO·yFe2O3粉末配成铝热剂,再分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放人足量的烧碱溶液中充分反应。前后两种情况下生成的气体质量比是5:7,则x:y为
A.1 : 2 B.1 : 1 C. 5 : 7 D. 7 : 5
8.钡和钠相似,也能形成含O22-离子的过氧化物,下列叙述不正确的是
A.过氧化钡的化学式是Ba2O2
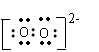 B.1 mol过氧化钡或过氧化钠跟足量的水反应都生成0.5 mol氧气
B.1 mol过氧化钡或过氧化钠跟足量的水反应都生成0.5 mol氧气
C.O22-离子的电子式为
D.过氧化钡或过氧化钠都是强氧化剂
 9、(本题共14分)某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
9、(本题共14分)某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
【实验设计】
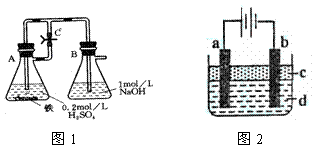
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有: 。
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀。请从所提供的试剂或电极材料中选择正确的序号填在横线上:①纯水 ②NaCl溶液 ③NaOH溶液 ④四氯化碳 ⑤CuCl2溶液 ⑥乙醇 ⑦Fe棒 ⑧植物油 ⑨碳棒
a为___________,b为___________,c为___________,d为___________。(填序号)
【探究思考】实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色Fe(OH)3。这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+。 |
阅读该资料后,你对上述实验中出现灰绿色或绿色的现象的解释是:__________ ;资料中提及的微绿色Fe3(OH)8,用氧化物的形式表示可写成__________________。
(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2·nH2O所致。用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势。
加热时,“方法一”中弹簧夹C应处于___________(填“打开”或“关闭”)状态,容器A中的反应须处于___________(填“停止”或“发生”)状态。写出该实验中支持乙同学观点的化学方程式_______________。
(3)欢迎你参加该研究小组的讨论,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路。 。
10.(10分)已知A为中学化学中的常见金属,X、Y为常见非金属。X、E、F、G、J常温下为气体,C为无色液体,B是一种盐,受热易分解。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图(部分反应的条件、生成物被略去):
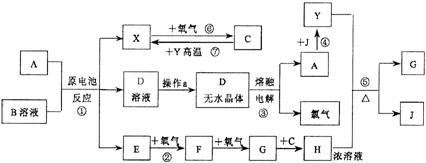
请填写下列空白:
⑴金属A为 ;操作a是将D溶液在HCl气流中蒸干,原因是
⑵反应②的化学方程式为: ;
反应⑤的化学方程式为: 。
⑶原电池反应①中,正极反应式为: 。
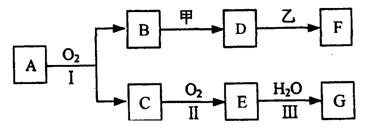
11.(11分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
(1)若A为黄色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应I在 中进行,反应Ⅲ在 (均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是 或 。
③反应I的化学方程式是 。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则①甲的电子式是 。
②D的溶液与乙反应的离子方程式是 。
③若1.7gA与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:
12.(9分)将Na2O2>和NaHCO3固体混合物置于密闭容器中加充分反应,放出气体后冷却。加热时可能发生的反应如下:
2 Na2O2+2NaHCO3![]() 2NaOH+2Na2CO3+O2↑
2NaOH+2Na2CO3+O2↑
2 Na2O2+4NaHCO3![]() 4Na2CO3+O2↑+2H2O
4Na2CO3+O2↑+2H2O
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)若固体混合物的质量为m,反应后冷却再称其质量减少了△m。设NaHCO3、Na2O2的物质的量分别为a,b,试确定下列条件下△m的取值范围(用含m的代数式表示)。
①当a/b≤1时,△m取值范围是
②当1<a/b≤2时,△m取值范围是
③当a/b>2时,△m取值范围是
(2)若m=14.52g,△m=1.28g时,向反应后的残留固体内滴加2.00mol/L盐酸140.0mL,可产生标准状况下的气体 L。
9. (14分)【实验设计】方法一:B;Fe+H2SO4=FeSO4+H2↑、FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、H2SO4+2NaOH=Na2SO4+2H2O 中和反应方程式不写不扣分
方法二:⑦、⑨或⑦、⑧、②。(每空1分,共6分)
【探究思考】(1)(共3分)由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3(1分)。
|
(2)(共3分,各1分)打开,发生,Fe(OH)2·nH2O= Fe(OH)2+ nH2O。
(3)(共2分)向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色(或者可以将Fe(OH)3和Fe(OH)2混合后观察其颜色。)(合理答案均给分)
10.⑴镁(Mg) 防止金属离子(Mg2+)水解
⑵4NH3+5O2![]() 4NO+6H2O C+4HNO3(浓)
4NO+6H2O C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
⑶2NH4++2e-=2NH3↑+H2↑(每小题2分,共10分)
11.(11分)(1)①沸腾炉 吸收塔(每空1分,共2分)
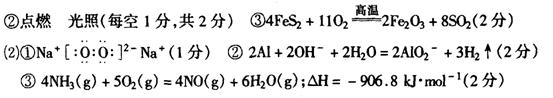 13。2.24L
13。2.24L