高三化学高错误率习题强化训练之一
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分150分。考试时间120分钟。
第I卷(选择题 共74分)
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 K-39 Fe—56
Mn-55 Pd-106.4
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭表面温度过高,可在火箭表面涂上一种特殊的化学物质,该物质最可能具有的性质是
A.硬度很大、熔点很高 B.高温下可分解气化
C.良好的热稳定性 D.较强的还原性,易燃烧
2.下列各项表达正确的是
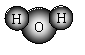 A.H2O的分子模型示意图:
B.F的结构示意图:
A.H2O的分子模型示意图:
B.F的结构示意图:
C.乙烯分子的结构简式:CH2CH2
D.CaCl2的电子式:![]()
3.科学家最近发现了一种只由四个中子构成的粒子R,这标志着人类对化学微观世界的研究又取得了新的进展。下列有关R的说法不正确的是
A.R与其他原子一样呈电中性 B.R的质量数与4He相同
C.与氢元素的质子数相同 D.R中不含质子可称为“零号元素”
4.苹果汁是人们喜爱的饮料,由于其中含有亚铁离子,在榨取后不久往往会变为棕黄色,
生产上常在其中加入维生素C以防止其变色,这是利用了维生素C的
A.氧化性 B.还原性 C.酸性 D.碱性
5.下列现象或应用中,不能用胶体知识解释的是
A.在饱和FeCl3溶液中逐滴加入NaOH溶液,产生红褐色沉淀
B.用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
C.清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱
D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
6.下列有关溶液的叙述中,正确的是
A.强电解质在水中溶解度一定大于弱电解质在水中的溶解度
B.将20℃时KCl溶液降低温度,所得溶液的质量分数一定会减小
C.某物质饱和溶液的质量分数为a%,该温度下该物质的溶解度一定大于ag/100g水
D.将标准状况下的饱和CO2水溶液置于常温下,一定会放出CO2气体
7.利用下图装置做下面的实验:在烧杯中盛有半杯乙溶液,然后用滴定管向容器中滴入甲溶液。随着甲的滴入,灯泡逐渐变暗;滴到一定量时,灯泡熄灭,继续滴入甲溶液,灯泡又逐渐变亮。下列各组溶液中,能够产生上述现象的是
| 选项 | 甲 |
|
| A | NH3·H2O | AgNO3 |
| B | CH3COOH | NH3·H2O |
| C | NaOH | AlCl3 |
| D | H2SO4 | Ba(OH)2 |
8.被誉为“太空金属”的钛,在室温下,不与水、稀盐酸、稀硫酸和稀硝酸等作用,但易溶于氢氟酸,你认为其原因可能是
A.氢氟酸的酸性比其它酸强 B.氢氟酸的氧化性比其它酸强
C.氢氟酸的还原性比其它酸强 D.钛离子易与氟离子形成可溶性难电离物质
二、选择题(本题包括10小题,第9-16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.1919年,Langmuir提出等电子体的概念:原子数相同、电子总数相同的分子,互称为等电子体;此后,等电子原理又有所发展,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体。等电子体的结构相似、物理性质相近。根据上述原理,下列各对粒子中,空间结构相似的是
A.SO2与O3 B.CO2与N2O C.CS2与NO2 D.PCl3与BF3
 10.在硫酸工业生产中,SO3的吸收过程是在吸收塔(如右图)中进
10.在硫酸工业生产中,SO3的吸收过程是在吸收塔(如右图)中进
行的,吸收塔里还装入了大量瓷环。下列有关SO3说法中,不正确的
是
A.从①处通入SO3,整个吸收操作采取逆流的形式
B.从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积
C.从③处导出的气体只含有少量SO2,可直接排入大气
D.从④处流出的是可用水或稀硫酸稀释的硫酸
11.有物质的量浓度、体积都相同的NaF溶液和NaCN溶液。已知HF比HCN较易电离。以下说法中正确的是
A.两溶液相比较,NaCN溶液中的离子总数较多
B.两溶液中的c(Na+) 、c(H+)分别相等
C.NaCN溶液中c (OH-) = c (H+) + c(HCN)
D.NaF溶液中c(Na+) > c (F-) > c(OH-) >c(H+)
12. 下列选项中所涉及到的两个量一定相等的是
A.等物质的量的Al分别与足量的盐酸、烧碱反应转移的电子数
B.36gH2O和1.204×1024个O2在标准状况下的所占体积
C.pH相等的氨水与醋酸钠溶液中由水所电离出的OH—浓度
D.pH相等的H2SO4和CH3COOH稀释相同倍数之后溶液的pH
13.下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是
A.K+、MnO4-、SO42-、Cl- B.Ca2+、HCO3-、NO3-、SO42-
C.Na+、AlO2-、NO3-、CO32- D.NH4+、SO42-、S2-、Cl-
14.下列离子方程式中正确的是
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C.苯酚钠溶液中通入少量CO2:![]() -O-+CO2+H2O→
-O-+CO2+H2O→![]() -OH+HCO3-
-OH+HCO3-
D.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl-=2Fe3++Br2+4Cl-
15.在铜的催化作用下氨气和氟气反应,得到一种三角锥形分子M和一种铵盐N。下列有关说法不正确的是
A.该反应的化学方程式为4NH3 + 3F2 = NF3 + 3NH4F
B.M是极性分子,其还原性比NH3强
C.M既是氧化产物,又是还原产物
D.N中既含有离子键,又含有共价键
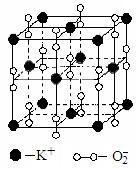 16.高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是
16.高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是
A.超氧化钾的化学式为KO2,每晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧原子与-2价氧原子的数目比为3:1
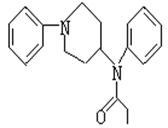
17.2002年10月26日,俄罗斯特种部队在解救 歌剧院人质时所使用的气体芬太奴,是医
|
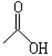
麻木,大量使用能使人昏迷乃至死亡。已知CH3COOH结构简式可表示为 ,
|
下列关于芬太奴的说法正确的是 ( )
A.芬太奴在一定条件下可发生水解反应 B.该分子中所有原子可以共平面
C.芬太奴属于苯的同系物 D.芬太奴的分子式为C20H24N2O
18.在25℃时,若1体积的某强酸溶液与10体积的某强碱溶液混和后,溶液恰好呈中性,则混和之前,该强酸溶液的pH与该强碱溶液的pH之和等于
A.12 B.13 C.14 D.15
第II卷(非选择题 共76分)
三.(本题包括2小题,共20分)
19.(8分)⑴现有0.1mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是 。纯碱溶液呈碱性的原因(用离子方程式表示)是 ,你认为该溶液pH的范围一定介于 之间。
⑵为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案。
20.(12分)已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化:
MnO4-+C2O42-+H+→Mn2++CO2↑+H2O(未配平)
 MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O
MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中并定容;从中取出25.00mL待测液置于锥形瓶中,再用0.0200mol·L-1KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应。
试回答下列问题:
⑴配平: MnO4-+ C2O42-+ H+― Mn2++ CO2↑+ H2O
⑵0.0200mol·L-1KMnO4标准溶液应置于 (选填“甲”或“乙”)滴定管中;滴定终点如何判断 。
⑶你能否帮助该研究小组求得软锰矿中MnO2的质量分数 (选填“能”或“否”)。若回答“能”,请给出计算结果;若回答“否”,试说明原因 。
⑷若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是 。
A.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
B.滴定前尖嘴部分有一气泡,滴定终点时消失
C.定容时,俯视刻度线
D.滴定前仰视读数,滴定后俯视读数
E.锥形瓶水洗之后未用待测液润洗
四.(本题包括2小题,共20分)
21.(8分)A、B、C、D均为4种常见的短周期元素,常温下A、B可形成两种常见的液态化合物,其最简式分别为BA和B2A;B与D可形成分子X,也可形成阳离子Y,X、Y在水溶液中酸、碱性正好相反;C+的焰色反应呈黄色。
⑴C元素在周期表中的位置是 ;液态X类似B2A,也能微弱电离且产生电子数相同的两种离子,则液态X电离方程式为 。
⑵M、N是由A、B、C、D四种元素中任意三种元素组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且M溶液中水的电离程度小于N溶液中水的电离程度。 则M、N分别为(填化学式)_______________________ ;若将0.1mol·L-1M和0.2mol·L-1N两溶液等体积混合所得溶液中离子浓度的大小顺序为 _______________________________。
22.(12分)某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度是a g·cm-3。该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和HX。为了测定RX的分子量,拟定的实验步骤如下:
①准确量取该卤代烷b mL,放入锥形瓶中。
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子加热发生反应。
③反应完成后,冷却溶液,加稀HNO3酸化,滴加过量AgNO3溶液得到白色沉淀。
④过滤、洗涤、干燥后称重,得到固体c g。
回答下面问题:
⑴装置中长玻璃管的作用是_______。
⑵步骤④中,洗涤的目的是为了除去沉淀上吸附的______离子。
⑶该卤代烷中所含卤素的名称是______,判断的依据是_______。
⑷该卤代烷的分子量是______(列出算式)
⑸如果在步骤③中,加HNO3的量不足,没有将溶液酸化,则步骤④中测得的c值(填下列选项代码)______。
A、偏大 B、偏小 C、不变 D、大小不定
五.(本题包括2小题,共18分)
23.(8分)科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
⑴已知:H2的燃烧热为285.8KJ ·mol-1,试写出H2的完全燃烧的热化学方程式:
。
⑵某学生查阅大量资料,提出下列“22世纪用水制取氢气的研究方向”:
①研究在水不发生化学反应的情况下制取氢气,同时释放能量
②设法将太阳光聚焦,产生高温,使水分解产生氢气
③寻找高效催化剂,大力提高水在一定条件下分解产生氢气的转化率
④寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
请你从上述研究方向中,选择其中不正确的一项,并简述其理由
。
⑶用氢作为能源亟待解决的又一问题是贮氢材料的开发,研究表明某些过渡金属能与氢原子形成氢化物,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,(如LaH2.76)。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64g/cm3),试写出钯(Pd)的氢化物的化学式 。
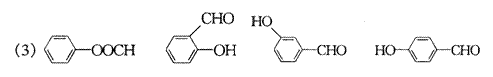
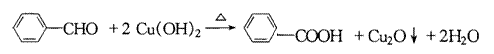
24.(10分)已知有机物A和C互为同分异构体且均为芳香族化合物,相互转化关系如下图所示:
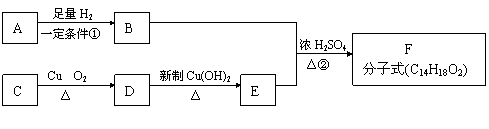 |
请回答下列问题:
(1)写出有机物F的两种结构简式 ,
;
(2)指出①②的反应类型:① ;② ;
(3)写出与E互为同分异构体且属于芳香族化合物所有有机物的结构简式
;
(4)写出发生下列转化的化学方程式:
C→D ,
D→E 。
六、(本题包括2小题,共18分)
25.(8分)有两份溶液,其中所含溶质相同,设其摩尔质量为Mg/mol。
根据下表信息,回答有关问题:
| 溶质的质量分数 | 溶液的密度(g·cm-3) | |
| 第一份溶液 | ω1 | ρ1 |
| 第二份溶液 | ω2 | ρ2 |
⑴第一份溶液中,溶质的物质的量浓度为 。
⑵取等质量两份溶液混合,则所得混合液中溶质的质量分数ω3= 。
⑶若有ω1>ω2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为ω4,试比较ω3、ω4的相对大小? 。
26.(10分)2.80g铁与100mL稀硝酸混合后充分反应,产生气体为NO,反应后铁、硝酸均无剩余。向反应后的溶液中加入100mL0.2mol/L的碘化钾溶液,恰好将溶液中的Fe3+全部还原。
求原硝酸溶液的物质的量浓度。
参考答案及评分标准
一、二:选择题1.B 2.A 3.C 4.B 5.A 6.C 7.D 8.D
9.AB 10.C 11.CD 12.A 13.C 14.AC 15.B 16.AD 17.AD 18.B
三.(本题包括2小题,共20分)
19.(8分)⑴把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH CO32-+H2O![]() HCO3-+OH- 7到13………………………………………………………………………(每空2分)
HCO3-+OH- 7到13………………………………………………………………………(每空2分)
⑵向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,
产生白色沉淀,且溶液的红色褪去。说明纯碱溶液呈碱性是由CO32-引起的。……(2分)
20.(12分)⑴2 5 16 2 10 8 ⑵甲 当看到加入1滴KMnO4溶液,锥形瓶中溶液立即变成紫红色,且半分钟内不褪色,即达到滴定终点 ⑶否 因为不知道容量瓶的规格 ⑷BC……(每空2分)
四.(本题包括2小题,共20分)
21.(8分)⑴第3周期第IA族 ⑵2NH3![]() NH4++NH2- ⑶NaOH和NH4NO3
NH4++NH2- ⑶NaOH和NH4NO3
c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) ……………………………………(每空2分)
22.(12分)
五.(本题包括2小题,共18分)
23.(8分)⑴2H2(g)+O2(g)=2H2O(l);△H= —571.6KJ·mol-1 ……………………(2分)
⑵①不正确,水分子中不含氢分子,不可能在不发生化学反应的情况下得到氢气,且水分解是吸热反应(或③不正确,催化剂不能使化学平衡发生移动,故不能提高水分解产生氢气的转化率) ⑶PdH0.8(写成Pd5H4也给分)…………………………………(每小题3分)
|
|
(2)加成、酯化(取代)(2分)
 |
(4分)
|
|
(2分)
 |
六、(本题包括2小题,共18分)
25.⑴![]() g/mol ……………………………………………………………………(2分)
g/mol ……………………………………………………………………(2分)
⑵![]() …………………………………………………………………………(2分)
…………………………………………………………………………(2分)
⑶①若ρ1>ρ2,ω4>ω3;②若ρ1<ρ2,ω3>ω4…………………………………………(4分)
26.n[Fe(NO3)3]=n(I-)=0.100L×0.2mol/L=0.020mol
n[Fe(NO3)2]=n(Fe)-n[Fe(NO3)3]=![]() -0.020mol=0.030mol……………(3分)
-0.020mol=0.030mol……………(3分)
根据电子守衡:
n[Fe(NO3)3]×3+ n[Fe(NO3)2]×2=n(NO)×3
0.020mol×3+0.030mol×2= n(NO)×3
n(NO)=0.040mol ………………………………………………………………………(3分)
根据氮元素守衡:
n(HNO3)= n(NO)+ n[Fe(NO3)3]×3+ n[Fe(NO3)2]×2
=0.040mol+0.020mol×3+0.030mol×2
=0.16mol
c(HNO3)=![]() …………………………………………………(4分)
…………………………………………………(4分)
 乙
乙