高三化学环境化学题
环境问题,与生活联系密切,多数陌生度高,因而有难度。
●难点磁场
请试做下列题目,然后自我界定学习本篇是否需要。
人体血红蛋白中含有Fe2+,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变成Fe3+,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可以缓解亚硝酸盐的中毒,这说明维生素C具有
A.酸性 B.碱性 C.氧化性 D.还原性
●案例探究
[例题]在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应(其中N均为-3价):
KCN+2KOH+Cl2![]() KOCN+2KCl+H2O。
KOCN+2KCl+H2O。
被氧化的元素是_______________。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:
KOCN+KOH+Cl2→CO2↑+N2↑+KCl+H2O
(3)若处理上述废水20.0 L,使KCN完全转化为无毒物质,至少需液氯______g。
命题意图:以废水处理为载体,考查学生对氧化还原反应的认识及有关化学计算的能力。
知识依托:氧化还原反应及根据化学方程式的计算。
错解分析:不能准确判定KOCN中C、N元素的化合价,导致配平及计算结果错误。
解题思路:KCN被Cl2氧化分两步完成,第一步:![]() ,先氧化还原性较强的C元素;第二步:
,先氧化还原性较强的C元素;第二步:![]() ,再氧化还原性较弱的N元素:
,再氧化还原性较弱的N元素:
2KO![]() +4KOH+3
+4KOH+3![]() 2→2CO2↑+
2→2CO2↑+![]() 2↑+6K
2↑+6K![]() +2H2O
+2H2O
↓ ↑
2×3 6×1
KCN转变为无毒的N2和CO2,与Cl2存在如下关系:
![]()
n(KCN)=650 mg·L-1×20.0 L×10-3 g·mg-1÷65.0 g·mol-1=0.200 mol
n(Cl2)=![]() n(KCN)=
n(KCN)= ![]() ×0.200 mol=0.500 mol
×0.200 mol=0.500 mol
m(Cl2)=0.500 mol×71.0 g·mol-1=35.5 g
答案:(1)碳(或C)
2KOCN+4KOH+3Cl2==2CO2+1N2+6KCl+2H2O
(3)35.5
●锦囊妙计
环境问题的顺利解决需要:
1.多关注社会问题,从中学到教科书上没有的知识。
2.多联系生活实际,学以致用,将死的书本知识活化到现实生活中来,应用所学知识解决生活中所遇到的实际问题。
●歼灭难点训练
1.(★★★)六氯苯是被联合国有关公约禁止或限制使用的有毒物质之一,下式中能表示六氯苯的是
2.(★★★★)康泰克等常用治疗感冒药品中含苯丙醇胺(又称盐酸苯丙醇胺或盐酸去甲麻
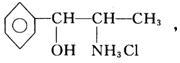
黄碱) 人服用后会产生负作用:过敏、心律失调、高血压、
急性肾衰、失眠等。最近停止使用,这是2000年最引人关注的社会问题之一。
(1)苯丙醇胺的英文缩写是________
A.PPb B.PPA C.PPm D.APC
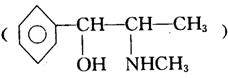
(2)与盐酸苯丙醇胺有类似作用的麻黄碱如果
保持甲基数目不变,含有羟基且羟基及N原子距苯环位置不变,其同分异构体共有______种。
3.(★★★★)致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。人们曾采用过乙醚、NH3、CH3Cl等作致冷剂,但它们不是有毒,就是易燃。于是科学家根据元素性质的递变规律来开发新的致冷剂。据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期________>________>H2O、HF;
第三周期SiH4>PH3>________>________。
(2)化合物的毒性:PH3>NH3,H2S________H2O;CS2________CO2,CCl4>CF4(选填“>”或“<”)。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8℃。CF4的沸点为-128℃。新致冷剂的沸点范围介于其间。经过较长时间反复试验,一种新的致冷剂氟利昂CF2Cl2终于诞生了,其他类似的还可以是______。
(4)然而,这种致冷剂造成了当今的某一环境问题是 。但求助于元素周期表中元素及其化合物的 变化趋势来开发致冷剂的思维方法是值得借鉴的。(填写字母,多选扣分)
①毒性 ②沸点 ③水溶性 ④颜色
a.①②③ b.①②④ c.②③④
4.(★★★★★)我国规定饮用水质量标准必须符合下列要求:
| pH | 6.5~8.5 |
| Ca2+、Mg2+总浓度 | <0.0045 mol·L-1 |
| 细菌总数 | <100个·mL-1 |
以下是源水处理成自来水的工艺流程示意图:
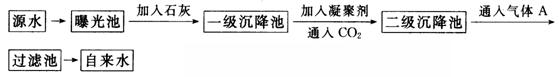
(1)源水中含Ca2+、Mg2+、HCO-3、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式______________________。
(2)凝聚剂除去悬浮固体颗粒的过程是_____________(填写编号,多选倒扣)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4·7H2O是常用的凝聚剂,它在水中最终生成_____________沉淀。
(3)通入CO2的目的是_______________和_______________。
(4)气体A的作用是____________________,这种作用是基于气体A和水反应的产物具有__________性。
(5)下列物质中,_______可以作为气体A的代用品(填写编号,多选倒扣)。
①Ca(ClO)2 ②NH3 (l) ③K2FeO4 ④SO2
附:参考答案
难点磁场
提示:Fe2+被亚硝酸盐氧化成Fe3+,从而使血红蛋白丧失了与O2结合的能力,因而有毒,缓解其毒性的方法是使Fe3+重新变回Fe2+,维生素C能够缓解亚硝酸盐中毒,说明维生素C有还原性。
答案:D
歼灭难点训练
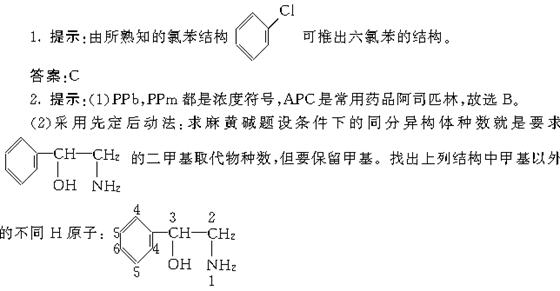
共6种,分别将1个甲基固定在1~6位,让另1个甲基转动,注意不要重复,可得其二甲基取代物种数:
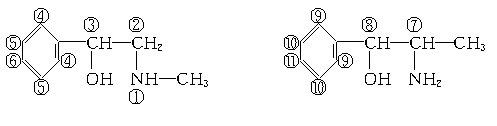
 答案:(1)B (2)20
答案:(1)B (2)20
3.提示:(1)还原性越强,越易自燃。
(2)可由元素周期表推出,也可由所学知识(H2S剧毒、CO2无毒)而填写。
(3)由新致冷剂的沸点可以推测其分子为甲烷的氟氯代物,还可以是:CFCl3、CF3Cl。
(4)氟氯代烃逸入空气可以使臭氧层被破坏,形成臭氧空洞。
题给研究思路分析了元素周期表中元素的易燃性、毒性和沸点。
答案:(1)CH4 NH3 H2S HCl (2)> > (3)CFCl3、CF3Cl
(4)形成臭氧空洞 a
4.提示:(1)含有Ca2+、Mg2+、HCO![]() 、Cl-的水中加入Ca(OH)2,可发生多种化学反应:
、Cl-的水中加入Ca(OH)2,可发生多种化学反应:
HCO![]() +OH-====H2O+CO
+OH-====H2O+CO![]()
Mg2++2OH-====Mg(OH)2↓
Ca2++HCO![]() +OH-====H2O+CaCO3↓
+OH-====H2O+CaCO3↓
Mg2++2HCO![]() +2Ca2++4OH-====Mg(OH)2↓+2H2O +2CaCO3↓
+2Ca2++4OH-====Mg(OH)2↓+2H2O +2CaCO3↓
答案可选其一。
(2)加入凝聚剂(可依FeSO4·7H2O而分析)前水溶液呈碱性(因加入石灰),所以加入FeSO4·7H2O发生如下反应:
Fe2++2OH-====Fe(OH)2↓ 4Fe(OH)2+O2+2H2O====4Fe(OH)3
生成的Fe(OH)3胶体可吸附水中悬浮的杂质。可见,凝聚剂除去水中悬浮颗粒是“化学和物理过程”。
(3)通入CO2的目的是除去加入的过量的石灰
Ca(OH)2+CO2====CaCO3↓+H2O
即除去Ca2+和调节溶液的pH,但应谨防通入的CO2过量,否则不能除去Ca2+。
(4)二级沉降后的水中应通入Cl2,进行杀菌消毒,因为Cl2与水反应有强氧化性物质(HClO)生成。
(5)具有强氧化性的物质,只要不能造成环境污染,便能成为Cl2的替代品,工业上常用的是Ca(ClO)2和K2FeO4。K2FeO4之所以有强氧化性是因为其中Fe元素具有较高的价态:+6,而我们已经知道Fe3+是具有强氧化性的,那么FeO![]() 的氧化性更强。
的氧化性更强。
答案:(1)HCO![]() +OH-====CO
+OH-====CO![]() +H2O或Mg2++2OH-====Mg(OH)2↓或
+H2O或Mg2++2OH-====Mg(OH)2↓或
Ca2++HCO![]() +OH-====CaCO3↓+H2O (2)③ 胶状Fe(OH)3 (3)除去Ca2+ 调节pH
(4)杀菌消毒 强氧 (5)①③
+OH-====CaCO3↓+H2O (2)③ 胶状Fe(OH)3 (3)除去Ca2+ 调节pH
(4)杀菌消毒 强氧 (5)①③