高三化学回归课本一(实验突破)
一.实验基本操作:
1.如何判断沉淀已经完全?
2.如何洗涤沉淀?如何判断沉淀已经洗干净?
3.如何用25.00 ml的碱式滴定管来准确量取25.00 ml的碱液?
4.关于试剂的保存:(广口玻璃瓶、广口橡胶塞的玻璃瓶、细口橡胶的玻璃瓶、细口玻璃塞的玻璃瓶、棕色瓶)上述仪器存放药品的要求
5.需要水浴加热的实验有?需要使用温度计的实验有?
6.NH4+ 的检验方法、NH3 的检验方法、氯气的检验方法
7.pH的测定
8.滴定管的润洗、如何赶清滴定管中的气泡?
9.如何使用分液漏斗滴加液体?
10.中和热测定所需的玻璃仪器有哪些?
11.在操作正确的前提下提高中和热测定的准确性的关键是(提高装置的保温效果)
13.标出仪器使用温度的是(量筒、容量瓶、滴定管)
12.过滤所用的玻璃仪器有哪些?
14.如何判断皂化反应基本完全?
15.玻璃棒在中学化学实验中一般有如下三种用途:搅拌、引流和蘸取溶液,下列实验中玻璃棒的作用:①配制一定物质的量浓度的溶液 ②硫酸铜晶体里结晶水含量的测定
③用硫酸铜晶体和氢氧化钠溶液制取氧化铜④测定某溶液的pH⑤从草木灰中提取钾盐
16.如何分离苯和碘单质的混合物?(蒸馏)
17.设计一个简单的实验证明纯碱溶液呈碱性是由CO32— 引起的?
18.分离混合物的方法有:蒸馏、分液、过滤、盐析、渗析、结晶(加热蒸发和冷却热饱和溶液,如KNO3(NaCl)、 NaCl(KNO3)如何除杂?)、加热升华、沉淀、氧化还原、重结晶
19.浓硫酸和浓硝酸的混合方法、浓硫酸和乙醇的混合方法
20.中和滴定终点的判断?
21.在硫酸铜晶体结晶水含量测定实验中,如何判断结晶水已经失干净?
22.容量瓶的使用、滴定管的使用、试纸的使用(除pH试纸的使用)、量气装置的使用、淀粉碘化钾试纸(检验Cl2的性质)、分液漏斗(分液)的第一步操作
23.用托盘天平称量时,如何判断天平是否已经平衡?(让指针在刻度盘两边等幅摆动)
24.如何检查容量瓶是否漏水?(一册163页)
25.通过案例分析,归纳检查装置气密性的一般方法?(热涨冷缩、压强差)
26.如何判断仪器洗涤是否干净?
27.用排水集气法收集气体时,如何判断何时开始收集?(在验纯后开始收集)
28.如何判断淀粉水解已经完全?(向溶液中加入碘单质,如果溶液不变蓝,证明已经水解完全。)
实验突破的答案:
1. 将溶液静置,然后去上层清液加入沉淀剂,如果没有沉淀,则沉淀已经完全。
2. 向漏斗中加入蒸馏水至淹没沉淀,但不超过滤纸的边缘,然后静置,待洗涤液流完后,重复以上操作2-3次。
取最后一次洗涤液,向其中加入试剂(不一定是沉淀剂),如果没有沉淀,则沉淀已经洗涤干净
3. 向碱式滴定管中加入碱液至0刻度线以上,然后迅速排净管内的气泡,在调整液面至0刻度线,然后放液至25.00ml。
4. 主要思考的对象:固体、液体、碱性试剂、酸性试剂、强氧化性试剂、易分解的试剂
5. 水浴加热的有:银镜反应、蔗糖的水解、苯的硝化、酯类的水解、
需要温度计的有:苯的硝化、酯类的水解、乙烯的制取、石油的蒸馏
需要加入碎瓷片的实验有:乙烯的制取、石油的蒸馏、乙酸乙酯的制取(该实验如果量少也可不加)
6. 加入强碱加热,能否释放出碱性气体。用湿润的红色石蕊试纸看是否变蓝。
用湿润的KI淀粉试纸,看是否变蓝。
7.用玻棒沾取待测液点滴与试纸的中央,并在30s内与标准比色卡进行对比,进行读数。
8.第二册课本228爷
9.打开分液漏斗上口活塞,旋开分液漏斗的旋塞,缓慢滴加
14.用玻棒沾取一滴混合物加入到水中,在液体表面不在形成油滴(或者油脂全部消失)
17.先向Na2CO3溶液中加入酚酞,溶液呈红色,然后在加入CaCl2至沉淀完全,溶液红色消失。
19.把密度大溶液的沿烧杯缓慢加入到密度小的溶液中,并用玻棒不断的搅拌。
20.当加入最后一滴溶液,锥形瓶内溶液颜色恰好发生明显变化,且在30秒内不改变,此时即为滴定的终点。
21.定性:晶体由蓝色由变成白色粉末,且不再有水蒸气逸出。
定量:最后两次称量误差不超过0.1g(用天平称量)
二.需要看课本的实验
定量实验:
一定量浓度溶液的配制(一册56页或一册167页)
① 步骤:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀
② 根据上述步骤回忆所需仪器。
酸碱中和滴定(二册69页或二册227页)
① 准备:检漏、水洗、润洗、装液、排气泡、调液面、读数
② 操作:左手控制滴定管、右手震荡锥形瓶、眼睛注视锥形瓶内溶液颜色的变化
③ 滴定终点的判断
④ 读数视线、刻度、凹液面的最低处,三者同在一水平线上。
⑤ 根据上述过程回忆所需仪器
⑥ 误差分析
硫酸铜晶体中结晶水含量的测定(三册11页)
① 所需实验用品
② 步骤:
③ 本实验中至少需要称量四次,哪四次?
④ 如何判断CuSO4已经完全失水?
⑤ 误差分析
中和热的测定(三册45页)
① 该实验所需实验用品(大烧杯、小烧杯、温度计、量筒两个、泡沫塑料板或硬纸板、环形玻璃搅拌棒)
② 在此实验中,使其中一种反应物过量目的是什么?
③ 在完成一次实验过程中需要称量几次温度?
在此实验中,如果用NaOH固体、浓硫酸、醋酸、氨水会使实验结果如何变化?
④数据的处理和误差的分析
性质实验:
利用Na2S2O3溶液与H2SO4的反应来进行浓度对化学反应速率的影响(实验现象、方程式)
利用FeCl3与KSCN的反应来进行浓度对平衡的影响(现象、方程式、Cl—和K+对平衡的影响)
Fe与水反应的实验(二册88页)及方程式
醛的性质实验(二册165页两个反应)
银氨溶液的配制过程和配制原理
银镜反应的方程式、反应条件
新制Cu(OH)2的配制过程及NaOH大大过量
醛与新制Cu(OH)2的方程式及反应条件
乙二酸的性质(三册82页)
乙二酸的酸性
乙二酸与Na2CO3溶液的反应
乙二酸受热分解的装置、方程式、反应产物的判断
乙二酸溶液中滴入酸性KMnO4
乙二酸与乙二醇反应的装置、方程式
乙二酸能使蓝墨水褪色
制取实验:
Cl2的制取(一册67页)
① 反应装置、尾气处理
② 反应原理及方程式
③ 如何除去氯气中的氯化氢
④ 实验室还可以用下列原理快速、制取少量氯气:
浓盐酸+ KMnO4、浓盐酸+ KClO3、
NH3的制取(二册13页)
① 反应装置及原理(方程式)
② 实验室还可以用下列原理快速、制取少量氨气:
浓氨水+ CaO、浓氨水+ NaOH、浓氨水受热分解
FeCl3 、FeCl2、SnCl2溶液的配制(二册66页)
主要是考虑水解、易被氧化
Fe(OH)2的制取(二册89页)
① 新制的FeSO4溶液、煮沸过的NaOH、滴管需插入液面以下、防此被空气中的氧气氧化
② Fe(OH)2在空气中的变质过程及方程式
乙烯的实验室制备(二册122页)
① 装置(特别是温度计的位置)
② 反应方程式及浓硫酸的作用
③ 投料量弄硫酸和乙醇(体积比:1/3)、温度的控制、碎瓷片的作用
石油的蒸馏(二册137页)
① 装置(温度计的位置、水流方向)
② 馏分仍是混合物
溴苯的制取、硝基苯的制取(高考金典的随堂练习)
醇分子中结构式的探讨(二册158页)
①反应的装置(特别是排水法收集气体的方法)
②该实验安全、顺利进行的关键实验步骤:检查实验装置的气密性;加入稍过量的金属钠;从漏斗中缓慢滴加无水乙醇。
③在对量筒进行读数时,要上下移动量筒使量筒中的液面与广口瓶中的液面相持平
银氨溶液的配制(二册165页)
向AgNO3溶液中逐滴加入氨水,直至最初产生的沉淀恰好完全溶解为止,这时所得到的溶液即为银氨溶液
乙酸乙酯的制取(二册168页或235页)
① 反应的装置(导管为什么不能插入液面以下?)
② Na2CO3溶液的作用、反应条件及方程式
③ 如何混合乙醇、乙酸、浓硫酸
酯的水解(二册169页)
反应的条件
皂化反应(二册235页)
① 所需仪器
② 乙醇的作用、NaOH溶液的作用、饱和NaCl溶液的作用
③ 如何分离皂化反应的产物从而来制取肥皂?
Fe(OH)3胶体的制取(三册15页)
向沸水中加入FeCl3饱和溶液,继续煮沸,待溶液呈红褐色,此时即为Fe(OH)3胶体
Al(OH)3制取的最佳方案(三册79页)
① 铝表面油污的洗涤
② Al(OH)3制取的最佳方案
③ 该实验中,通过热蒸馏水,利用倾析法对沉淀进行洗涤
④ 溶液pH的调整
硫酸亚铁的制备(三册81页)
① 工业中废铁屑表面的油污如何除去?
② 为里防此铁锈与硫酸生成含有Fe3+的溶液,在实验中应使铁屑过量
③ 本实验是利用重结晶法来制取硫酸亚铁
④ 为了增大硫酸亚铁的溶解量,在实验中给溶液进行了加热
⑤ 为了减少过滤时硫酸亚铁的损失,应将溶液进行热过滤
【反馈训练】
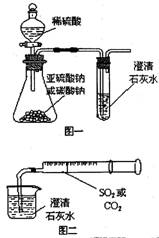 1.某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓缓地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象。
1.某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓缓地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象。
⑴本实验中生成CO2和SO2的有关反应的化学方程式为:
_________________________;________________________。
⑵对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是:___________________。
⑶用图二装置进行实验,以相同速率通入CO2和SO2时,SO2产生浑浊、澄清的现象比CO2快的原因可能是:
____________________________________。
⑷用图一进行SO2与石灰水反应的实验时,从安全或环境角度考虑,该装置可如何改进?
________________________________________________________________________。
答案:⑴Na2CO3+H2SO4=Na2SO4+CO2↑+H2O Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
⑵SO2溶解度大,与石灰水反应时SO2过量,直接生成酸式盐而看不到沉淀
⑶SO2溶解度大,且对应的亚硫酸酸性比碳酸强,SO2与石灰水比CO2反应快
⑷增加尾气吸收装置或增加防倒吸装置
下列实验操作不正确的是
1.做银镜反应的试管在反应前可用NaOH清洗,在反应后只可用浓硝酸洗
2.取体积比为3︰1的酒精和浓硫酸的混合液注入圆底烧瓶中慢慢加热到170℃来制得乙烯;
3.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动;
4.在实验室制取乙烯和石油分馏的过程中,温度计的水银球均插入液面以下;
5.将乙醇和浓硫酸反应的温度控制在170℃,乙醇会发生分子间脱水,生成乙醚;
6.用重结晶法可以除去硝酸钾中混有的少量氯化钠
7.可用启普发生器来制取乙炔;
8.在制取乙炔的实验中可通过分液漏斗来控制反应的速率;
9.电石气常混有特殊难问的臭味是因为电石中含有PH3、H2S;
10.可把KMnO4加入到苯和甲苯的混合物中,然后采取分液的方法分离;
11.在石油蒸馏过程中,蒸馏烧瓶的碎瓷片作用是防止液体暴沸;
12.苯加入到溴水中因发生化学反应而使溴水褪色;
13.可以通过点燃乙烷、乙烯、乙炔,观察其火焰的明亮程度和黑烟的浓度来区别乙烷、乙烯和乙炔;
14.甲苯、乙醛、CCl4、汽油四种物质只用水即可鉴别;
15.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯;
16.配制浓硫酸和浓硝酸的混合酸时,将浓硝酸沿器壁慢慢加入到浓硫酸中,并不断搅拌;
17.苯、浓硫酸和浓硝酸在水浴加热的条件下,可制得带有苦杏仁味、黄色的油状液体
18.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置,待液体分层后,滴加硝酸银溶液;
19.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入无水乙醇的试管中,完成乙醇氧化为乙醛的实验;
20.乙醇中还有少量水或乙酸都可以通过加入生石灰,再蒸馏制得无水乙醇;
21.向试管中先加入一定量浓硫酸,再依次及加入适量冰醋酸,无水乙醇,然后加热制取乙酸乙酯;
22.无法用分液漏斗将甘油和水的混合液分离;
23.石油的蒸馏是在分馏塔中进行,需要蒸馏烧瓶、温度计、冷凝管、牛角管、烧杯等玻璃仪器;
24.润滑油与NaOH可发生皂化反应
25.用浓溴水可以除去苯中混有的苯酚;
26.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止;
27.新制Cu(OH)2溶液可用来检验某病人是否患糖尿病;
28.2mL10%NaOH溶液中滴入1mL 2%CuSO4溶液,再加入乙醛溶液,加热煮沸,出现红色沉淀;
29.将乙醇和乙酸分离需要用到两次蒸馏;
30.制取乙酸乙酯和苯甲酸甲酯时,最好都采用冷凝回流的操作;乙酸乙酯的水解需在70℃~80℃的水浴中进行;
31.蔗糖水解时应用浓硫酸作催化剂;
32.向溴乙烷中加入氢氧化钠的醇溶液,再向其中加入硝酸银溶液,可看到淡黄色沉淀;
33.向苯酚溶液中加入少量溴水可出现白色沉淀;
34.在做银镜反应的实验中,反应前可用氨水洗试管壁,反应后可用稀硝酸洗试管壁;
35.乙酸乙酯加入到溴水中,可使溴水褪色,同时出现分层现象
36.向乙酸乙酯、乙酸、乙醇的混合溶液中加入饱和NaCO3,然后再分液从而可分离出乙酸乙酯;
37.进行纤维素水解实验时,把一小团脱脂棉放入试管中,滴入少量90%的浓硫酸搅拌,使脱脂棉变成
糊状,再加入一定量的水,加热至溶液呈亮棕色,然后加入新制的Cu(OH)2加热至沸腾即可出现红色沉淀;
38.在鸡蛋白溶液中滴入浓HNO3,微热会产生黄色物质;
39.“油脂皂化后静置,反应液不分层”可判断油脂皂化反应已经基本完成;
40.实验室制取肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂;
41.向蔗糖溶液中加入稀硫酸并放在水浴中加热,然后再加入银氨溶液加热可出现光亮的银
42.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
43.向蛋白质溶液中加入浓的Na2SO4溶液,然后再分液,即可分离出蛋白质;
44.油脂皂化后,使肥皂和甘油分别从混合液中充分分离出来,可采用盐析、分液的方法;
45.向淀粉的溶液中加入稀硫酸,然后加入过量的NaOH溶液和新制的Cu(OH)2悬浊液,水浴中加热,即可出现红色沉淀;
46.加热酚醛塑料不熔化说明该塑料具有热固性;
47.实验室需要进行水浴加热的有:苯的硝化、银镜反应、纤维素的水解、乙酸乙酯的水解等;
48.向Na2CO3与NaOH的混合液中加入足量的CaCl2溶液,再滴加几滴酚酞试液,可检验NaOH的存在;
49.检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置到充分沉淀后,取上层清夜于试管中,滴加KSCN溶液2~3滴即可;
50.以废铝屑为原料来制取Al(OH)3时,可先用少量稀的NaOH溶液,在加热的条件下洗去表面的油污;
51.制备硫酸亚铁晶体实验中,除去废铁屑表面的润滑油时最好用热的纯碱液;
52.向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽,此时所得溶液即
为FeSO4溶液;
53.以铝为原料制备Al(OH)3的实验中洗涤Al(OH)3沉淀的操作是:直接向过滤器中加入蒸馏水至刚
好淹没沉淀,静置,重复2~3次,至溶液的pH为7~8;
54.将FeSO4溶液加热、蒸发、结晶,所得晶体即为FeSO4晶体;
55.将乙二酸分别加入到KMnO4溶液和蓝墨水中,均褪色,其原理一样;
56.在对草酸晶体加热时,大试管应略向下倾斜;受热分解产物有CO2、CO、H2O;
57.给试管内液体加热时,液体体积不应超过试管容积的2/3;
58.可用碱式滴定管量取25.00mL溴水或高锰酸钾溶液
59.在探讨乙醇的分子结构时,可用碱式滴定管来代替分液漏斗,以便减少实验的误差;
60.测定溶液的pH值时,用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较
61.向某溶液中加入KSCN溶液,无现象,然后再加入氯水溶液的颜色变为红色,即说明溶液中含有Fe2+;
62.向一溶液中加入硝酸酸化的Ba(NO3)2,有白色沉淀生成,则原溶液中一定含有SO42—;
63.向某溶液中加入盐酸无明显现象,然后再加Ba(NO3)2,有白色沉淀生成则原溶液中一定含有SO42—;
64.过滤、蒸发操作过程中都需要用玻璃棒不断搅拌液体;
65.配制FeSO4溶液时,先将FeSO4溶解在少量浓盐酸中,再加水稀释,并加少量铁粉;
66.用灼烧方法可以区别真丝和人造丝;
67.实验室测定CuSO4·H2O晶体里结晶水n值时,若加热后无水硫酸铜粉末表面发黑,会使测定结果偏高;若晶体中含有受热不分解的物质也会使测定结果偏高;
69.在测定CuSO4·H2O晶体里结晶水的含量时,至少需加热两次,测量四次;
70.在皂化反应和CuSO4·H2O晶体里结晶水含量的测定时均用到坩锅和坩埚钳;
71.在中和热测定的实验中需要用的玻璃仪器有:大小烧杯、温度计、环形玻璃搅拌棒;
72.已烷中混有已烯,加入足量的溴水,充分振荡,静置分层后分离
73.将Fe(NO3)2溶液加热蒸发至干并灼烧,最后得到红棕色粉末
74.在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成
75.实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
76.在氢氧化铁胶体中滴加少量稀硫酸会产生沉淀
77.附着于试管内壁和皮肤上的苯酚,可用碱液洗涤
78.用渗析法分离淀粉中混有的NaNO3杂质
79.进行中和热测定实验时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度
80.用pH试纸测定某溶液是否为酸
81.用浓盐酸清洗用KMnO4制氧气后的试管
82.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
83.用冰醋酸、蒸馏水和容量瓶等仪器配制pH为1的醋酸稀溶液
84.用托盘天平称取5.2 g NaCl和用50 mL 量筒量取5.2mL盐酸
85.用蒸发皿加热NaCl溶液可以得到NaCl晶体
86.用100 mL容量瓶配制50 mL 0.1mol•L—1 H2SO4溶液
87.用带玻璃塞的棕色试剂瓶存放浓HNO3
88.中和热测定的实验中使用的玻璃仪器只有2种