高三年级化学错题过关
1、在平衡体系H2S![]() H++HS和HS-
H++HS和HS-![]() H++S2-中,增大溶液pH值时,则c(S2-)( )
H++S2-中,增大溶液pH值时,则c(S2-)( )
A.增大 B.减小 C.不变 D.可能增大可能减小
2、Na2HPO4
溶液呈碱性,其中存在下列电离平衡 HPO42-![]() H+
+PO43- ,要使溶液中 C(HPO42-),C(H+),C(PO43-) 均减小,可采用的方法是
(
)
H+
+PO43- ,要使溶液中 C(HPO42-),C(H+),C(PO43-) 均减小,可采用的方法是
(
)
A.加盐酸 B.加石灰 C.加热 D.用水稀释
3、某二元酸(H2A)按下式发生电离:H2A=H++HA—;HA—![]() H++A2-。有体积各为10mL的下列四种溶液:①0.02mol/L H2A溶液;②0.02mol/L NaHA溶液;③浓度均为0.02mol/L的Na2A和NaHA的混合溶液;④0.02mol/LNa2A溶液,则下列说法中正确的是
( )
H++A2-。有体积各为10mL的下列四种溶液:①0.02mol/L H2A溶液;②0.02mol/L NaHA溶液;③浓度均为0.02mol/L的Na2A和NaHA的混合溶液;④0.02mol/LNa2A溶液,则下列说法中正确的是
( )
A.四种溶液中c(H+)的关系:①>②>③>④
B.四种溶液中离子总数的关系:④>③>②>①
C.在②的溶液中一定有:c(Na+)>c (HA—)>c (OH—)>c (H+)
D.在①的溶液中:c (H+)=c(HA—)+c (A2—)+c (OH—)
4、一定温度下,将2mol A、2mol B、2mol C的气体混合物充入一体积不变密闭容器中,充分反应后恢复到起始温度,测得容器内的压强比起始时增大了20%,则容器中可能发生的反应是
A.2A+B![]() 2C B.A+B
2C B.A+B![]() 2C
2C
C.2A+2B![]() C D.A+B
C D.A+B![]() 3C
3C
5、恒容下的反应2SO2+O2![]() 2SO3,ΔH<0,达到平衡后,下列可以加快反应速率的方
2SO3,ΔH<0,达到平衡后,下列可以加快反应速率的方
法是 ()
A、 SO3分离出一部分 B、升温
C、充入少量N2,增大压强 D、充入少量SO3气体
6、可逆反应:3A(气) ![]() 3B(?)+C(?) (△H为正值 ),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是 ( )
3B(?)+C(?) (△H为正值 ),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是 ( )
A.、B和C可能都是固体 B、B和C 一定都是气体
C.、若C为固体,则B一定是气体 D、B和C可能都是气体
7、氟化氢气体能以(HF)n形式存在,已知氟化氢气体中存在下面的平衡:
2H3F3![]() 3H2F2 △H>0 , H2F2
3H2F2 △H>0 , H2F2![]() 2HF
△H>0 ,则下列说法不正确的 ()
2HF
△H>0 ,则下列说法不正确的 ()
A.若气体的平均摩尔质量为42g/mol,则H3F3 的体积分数必小于10%
B若气体的平均摩尔质量为40g/mol,则H3F3 的体积分数可能为10%.
C.若在定温、定容下再充入H3F3 ,则H3F3 和HF的浓度(mol/L)比值增大
D.若在定温、定容下再充入HF,则H3F3 和HF的浓度(mol/L)比值也增大
8、在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡移动的是:
混和物的浓度 B、 反应物的转化率 C、逆反应速率D、反应混和物的压强
9、恒温下,容积均为2L的密闭容器M、N中,分别有以下列两种起始投料建立的可逆反应3A(g)+2B(g)![]() 2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3 mol
A 2 mol B;2
min达平衡,生成D
1.2 mol,测得从反应开始到平衡C的速率为0.3
mol/(L·min)。N:2 mol
C y mol D;达平衡时c(A)=0.6
mol/L。下列推断的结论中不正确的是
2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3 mol
A 2 mol B;2
min达平衡,生成D
1.2 mol,测得从反应开始到平衡C的速率为0.3
mol/(L·min)。N:2 mol
C y mol D;达平衡时c(A)=0.6
mol/L。下列推断的结论中不正确的是
A.x=2 B.平衡时M中c(A)<0.6 mol/L C.y<0.8 D. y>0.8
10、在一密闭容器中加入C和CO2,建立平衡体系C(s)+CO2![]() 2CO(g);△H=Q(Q>0),下列说法中错误的是 ( )
2CO(g);△H=Q(Q>0),下列说法中错误的是 ( )
A、 降低压强升高温度,体系中混合气体的平均相对分子质量将减小
B、 在恒温恒容条件下,向平衡体系中添加一定量的CO2,当反应重新建立平衡后,混合气体的平均相对分子质量将减小
C、 在恒温恒容条件下,向平衡体系中添加一定量的N2,虽然容器内气体压强增大,但平衡不移动
D、向平衡体系增添一定量的CO2,而保持温度、压强不变,反应重新建立平衡后,混合气体平均相对分子质量将增大
11、在相同条件下(T=500K),有相同体积的甲、乙两容器。甲容器中充入1 g SO2和1 g O2;乙容器中充入2 g SO2和2 g O2。下列叙述错误的是
A、化学反应速率:乙>甲 B、平衡后的浓度:乙>甲
A. C、SO2的转化率:乙>甲 D、平衡后SO2的体积分数:乙>甲
12、某温度下,在一容积可变的容器中,反应2A(g)+B(g)![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4
mol、2
mol和4
mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向正反应方向移动的是
2C(g)达到平衡时,A、B和C的物质的量分别为4
mol、2
mol和4
mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向正反应方向移动的是
A. A、 均减半 B、 均加倍 C、 均增加1 mol D、 均减少1 mol
13.同温同压下,当反应物分解了8%,总体积也增加了8%的是 ( )
A.2NH3(气) ![]() N2(气)+3H2(气) B.2NO(气)
N2(气)+3H2(气) B.2NO(气) ![]() N2(气)+02(气)
N2(气)+02(气)
A.
C.2N2O5(气) ![]() 4N0(气)+02(气) D.2SO2(气)
4N0(气)+02(气) D.2SO2(气) ![]() 02(气)+2SO2(气)
02(气)+2SO2(气)
14.在密闭容器中,aA(气) ![]() bB(气)达到平衡后,保持温度不变,将容器体积增加l倍,当达到新平衡时,B的浓度是原来的60%,下列说法正确的是 ( )
bB(气)达到平衡后,保持温度不变,将容器体积增加l倍,当达到新平衡时,B的浓度是原来的60%,下列说法正确的是 ( )
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.a>b
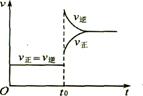 15、往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)
15、往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)![]() 2HI(g);△ H<0,当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是 (
)
2HI(g);△ H<0,当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是 (
)
A、容器内气体颜色变深,平均分子量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度变小
D、改变条件前后,速度图象为(如右图)
16、在一固定体积的密闭容器中,充入2molA和1molB,发生如下反应:2A(g) + B(g) xC(g) ,平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6molA 、0.3molB 和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是 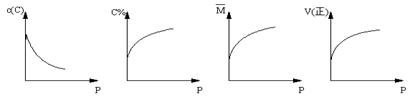
A B C D
17、同温下两种稀醋酸:甲溶液的物质的量浓度为c,乙溶液[CH3COO-]=c。下列的有关叙述中,正确的是
A、甲溶液的电离程度<乙溶液的电离程度
B、乙溶液物质的量浓度>甲溶液物质的量浓度
C、甲溶液的pH等于乙溶液的pH
D、 [H+]与乙溶液的[H+]之比为1/c
18、下列各组离子一定能在指定环境中大量共存的是 ( )
A、在c(HCO3-)=0.1mol/L的溶液中:Al3+、Cl-、NO3-
B、在由水电离出的c(H+)=10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO42-
C、在使甲基橙变红的溶液中:NO3-、SO42-、Na+、Fe3+
D、使pH试纸变深蓝色的溶液中,SO32-、S2-、Na+、K+
19、在一个容积恒定的容器中充入2
mol A和1mol B反应:2A(g)+B(g)![]() xC(g),达到平衡后,C的体积分数为W%,若维持容器的容积和温度不变,按起始物质的量A:0.6 mol、B:0.3 mol、C:1.4 mol 充入容器达到平衡后,C的体积分数仍为W%,则x的值为
xC(g),达到平衡后,C的体积分数为W%,若维持容器的容积和温度不变,按起始物质的量A:0.6 mol、B:0.3 mol、C:1.4 mol 充入容器达到平衡后,C的体积分数仍为W%,则x的值为
A、只能是2 B、只能是3 C、可能是2,也可能是3 D、无法确定
20、同时符合下列两个图像的反应是(温度T1>T2)( )
 v
v
![]()
![]() v逆 v正
v逆 v正
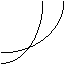 | |||
T1
![]()
![]() T2
T2
![]()
![]() 压强
时间
压强
时间
0 0
A、
N2O3(g)![]() NO2+NO;△H>0
NO2+NO;△H>0
B、CO2+C(s)![]() 2CO;△H>0
2CO;△H>0
C、3NO2+H2O(l)![]() 2HNO3(l)+NO;△H<0
2HNO3(l)+NO;△H<0
D、
NH3+5O2![]() 4NO+6H2O(l);△H<0
4NO+6H2O(l);△H<0
21、下列事实,不能用勒夏特列原理解释的是: ( )
A.溴水中有下列平衡: Br2+H2O![]() HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)![]() H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2 ![]() CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
D合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
22、某溶液中FeCl3的水解反应已达平衡.FeCl3+3H2O ![]() Fe(OH)3+3HCl若要使
Fe(OH)3+3HCl若要使
FeCl3的水解程度增大,应采取的方法是 ( )
A、加入NaHCO3 B、加热 C、加FeCl3固体 D、加入AgNO3
23、有一种酸式盐AHB,它的水溶液显弱碱性。下列说法中正确的是( )
A.同浓度的AOH溶液和H2B溶液,电离程度前者大于后者
B.该盐的电离方程式为AHB === A++HB-
C.HB-的电离程度大于HB-的水解程度
D.在溶液中离子浓度大小顺序一般为.c(A+)>c(HB-)>c(OH-)>c(B2-)>c(H+)
24、经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法错误的是()
A.溶液中四种粒子之间不可能满足:![]()
B.若溶液呈酸性,则一定满足:![]()
C.若溶液呈碱性,则一定满足:![]()
D.若溶液呈中性,则一定满足:![]()
25、pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
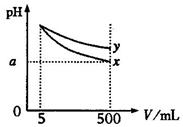 A.稀释后x溶液中水的电离程度比y溶液中水的电离程度小
A.稀释后x溶液中水的电离程度比y溶液中水的电离程度小
B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液y的pH大
C.完全中和x、y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y)
D.若x、y都是一元弱碱,则a的值一定大于9
26、25°C时,某溶液中由水电离出来的H+浓度为1×10—a mol/L,以下说法中正确的是
A.a>7时,水的电离一定受到促进 B.a<7时,水的电离一定受到抑制
C.a>7时,溶液的pH为a或14—a D.a<7时,溶液的pH为a或14—a
![]() 27、某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA- H++A2-。关于下列四种溶液的说法正确的是 ( )
27、某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA- H++A2-。关于下列四种溶液的说法正确的是 ( )
①0.01mol/L的H2A溶液
②0.01mol/L的NaHA溶液
③0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合
④0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合
A.四种溶液中c(HA-)浓度大小:③>①>②>④
B.溶液①中一定不存在OH-
C.溶液③中有关离子浓度关系:c(HA-)+c(A2-)=c(Na+)
D.溶液②中存在水解平衡:HA—+H2O H2A+OH—
28、在一定条件下,合成氨反应达到平衡后,混和气体中NH3的体积占25%。若反应前后条件保持不变,则反应后缩小的气体体积与原反应物体积的比值为
A. 1/5 B. 1/4 C. 1/3 D. 1/2
答案
1~5 D、B、A、CD、BD
6~10 CD、A、B、BC、BD
11~15 D、C、A、AC、AD
16~20 D、 B、CD、C、AB
21~25 B、AB、AB、AB、D
26~28 CD、AC、A