高三年级化学第五次月考
化 学 试 卷
可能用到的原子量:H:1 O:16 N:14 Na:23 Cl:35.5 C:12 Ca:40
Cu:64 S:32 Fe:56 Mg:24 Al:27 Zn:65
第I卷 选择题 (每小题只有一个选项符合题意。共54分)
1.目前,工业上冶炼铝通常采用的方法是 ( )
A.CO或氢气还原法 B.铝热反应法
C.电解法 D.热分解法
2.据最新报道,世界能源组织正在研究一项能源开发计划,旨在全球共同开采月球上含量
较为丰富的氦—3,它可以作为未来和平利用聚变反应能量的原料之一。下列属于He—3
的同位素的是 ( )
A.42He B.32He C.33Li D.73Li
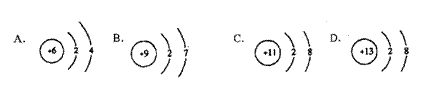
3.在下图所表示的微粒中,氧化性最强的是 ( )
4.能说明镁比铝还原性强的事实是 ( )
A.镁的价电子比铝少
B.镁带在空气中和CO2中能燃烧,而铝不能
C.镁遇浓硫酸不钝化,而铝钝化
D.铝的硬度、延展性、熔点均比镁大、好、高
5.具有单双键交替长链(如…CH=CH—CH=CH—CH=CH…)的高分子化合物有可能成为
导电塑料。2002年诺贝尔化学奖即授予了开辟该领域的三位化学家。下列高分子中,有
可能成为导电塑料的是 ( )
A.聚乙烯 B.聚丙稀 C.聚乙炔 D.酚醛树脂
6.用已知浓度的NaOH溶液滴定待测浓度的盐酸(盐酸置于锥形瓶中),以下操作会造成所
测盐酸溶液浓度偏低的是 ( )
A.酸式滴定管未用待装溶液润洗
B.碱式滴定管未用待装溶液润洗
C.锥形瓶未用待装溶液润洗
D.在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
7.有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它
们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是 ( )
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
8.下列离子方程式中,正确的是 ( )
A.硫酸亚铁溶液与过氧化氢溶液混合Fe2++2H2O2+4H+===Fe3++4H2O
B.小苏打溶液与稀硫酸混合 CO32-+2H+====CO2↑+H2O
C.明矾溶液滴入Ba(OH)2至SO42-完全沉淀
Al3++SO42-+Ba2++3OH-====Al(OH)3↓+BaSO4↓
D.饱和硫酸铁溶液加热时产生沉淀 Fe3++3H2O===Fe(OH)3↓+3H+
9.下列有机物在酸性催化条件下发生水解反应,生成两种不同的有机物,且这两种有机物
的相对分子质量相等,该有机物是 ( )
A.蔗糖 B.葡萄糖 C.丙酸丙酯 D.丙酸乙酯
10.向下列溶液中加入浓氨水直至过量,最终能得到无色澄清溶液的是 ( )
A.Al2(SO4)3溶液 B.AgNO3溶液 C.CuSO4溶液 D.MgCl2溶液
11.有甲、乙、丙、丁四种金属,将甲、乙用导线相连放入稀硫酸中可以看到乙慢慢溶解,而甲的表面有气泡逸出;把丁放到乙的硝酸盐溶液中后,丁表面覆盖一层乙的单质;用石墨电极电解含有相同物质的量浓度的甲和丙两种金属的盐溶液,丙的单质先析出;将甲放入稀盐酸中有H2析出,已知四种金属中有一种是铜,根据以上实验判断,铜是( )
A.甲 B.乙 C.丙 D.丁
12.建筑用的红砖和青砖,其颜色是由其中含有的不同价态的铁氧化物所致。我国古代砖瓦建筑能够保持到现在的,几乎无一例外的是由青砖建成。有人提出以下可能的原因:①青砖中含的是FeO;②青砖中含的是Fe3O4;③Fe2O3遇长期酸雨侵蚀会风化溶解使砖瓦强度降低;④Fe3O4性质稳定;⑤FeO性质稳定。你认为有道理的是 ( )
A.①③⑤ B.②③④ C.③⑤ D.①②③④⑤
13.一定量的Fe和Fe2O3混合物投入250ml2 mol/L的HNO3溶液中,反应完全后,无固体剩余,生成1.12L NO气体(标况),再向反应后溶液中加入1 mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是 ( )
A.450ml B.500ml C.400ml D.无法确定
14.下列各组离子在溶液中不能大量共存,但加入过量NaOH溶液或过量稀盐酸后均能得到澄清溶液的是 ( )
A.Fe3+、Cl-、Na+、SO42- B.Al3+、Na+、HCO3-、NO3-
C.Ag+、Na+、SO42-、NO3- D.AlO2-、CO32-、K+、Na+
15.维生素E在有“生命奇迹丸”的美称,它是一种脂溶性维生素,对抗衰老等有特殊作用,经研究发现维生素E有α、β、γ、δ四种类型,其结构简式如下:
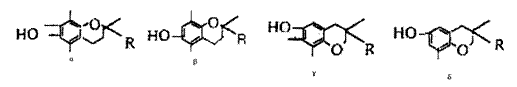
其中R为—CH2CH2CH2[CH(CH3)CH2CH2]2CH(CH3)2。上述互为同分异构体的是( )
A.α与β B.β与γ C.γ与δ D.α与δ
16.一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)=zC(g);△H<0,达到平衡后测得A气体的浓度为0.5mol·L-;当恒温下将密闭容器的容积扩大两倍并再次达到平衡时,测得A的浓度为0.3mol·L-。则下列叙述正确的是 ( )
A.平衡向右移动 B.x+y>z C.B的转化率提高 D.C的体积分数增加
17.若某电能与化学能的转化装置(电解池或原电池)中发生反应的总反应离子方程式是:
Cu+2H+===Cu2++H2↑,则关开该装置的有关说法正确的是 ( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,且金属铜为该电解池的阳极
D.该装置只能是电解池,电解质溶液不可能是盐酸
18.将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是 ( )
A.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
B.产物的平均摩尔质量为24g/mol
C.若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则压强变为原来的1/3
D.反应中消耗的氧气为56g
第Ⅱ卷 非选择题(共56分)
19.(8分)按要求回答下列问题:
(1)0.01mol/L的硫酸氢钠溶液的pH为 ,在其中滴入等体积的pH=12的Ba(OH)2溶液后,所发生反应的离子方程式为 。
(2)钢铁在潮湿的空气中生锈,有关的电极反应方程式为:
负极: ,正极: 。
(3)只用一种试剂可能把Fe、FeO、FeS、CuO、C、MnO2六种黑色粉末鉴别出来,该试剂是 ,其中,MnO2与该试剂反应的化学方程式为 。
(4)实验室配制硝酸汞溶液时,须将其晶体溶于稀硝酸中,其原因是 ,所涉及反应的离子方程式为 。
20.(6分)X、Y、Z三种元素位于周期表前20号元素之中。
已知:①XY2加水生成Y2Z2和化合物D;
②X的氧化物加水也生成D;
③Y的氧化物有两种。
请填空:(1)Y的最高价氧化物的电子式为 ,D的电子式为 。
(2)反应①的化学方程式为 。
(3)反应②的化学方程式为 。
21.(6分)在抗击非典型性肺炎期间,过乙酸(过氧乙酸)曾被广泛用作消毒剂。
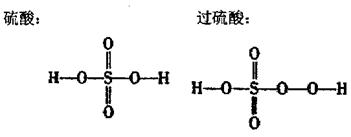
已知硫酸和过硫酸的结构简式如下:
|
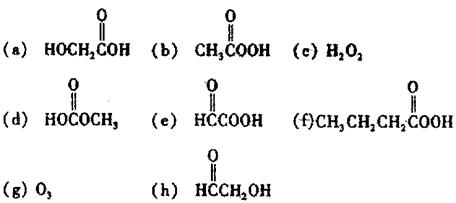
请从以下八个式中选择答案中回答下列问题(答案用编号表示,选错要倒扣分)。
|
(1)过乙酸(过氧乙酸)的结构简式是 。
(2)过乙酸的同分异构体是 。
(3)过乙酸的同系物是 。
22.(4分)乙知下列两个热化学方程式;
H2(g)+![]() O2(g)===H2O(1); △H=-285.kJ/mol
O2(g)===H2O(1); △H=-285.kJ/mol
C3H8(g)+5O2(g)===3CO2(g)+4H2O(1); △H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6264.5kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式。
23.(6分)实验室分析白铁(镀锌的铁)样品成分,称取1.00 g样品放在烧杯中。加入过量盐酸,然后用玻璃片盖住烧杯,首先观察到大量气体冒出,后来放出气体速率变慢,最后反应完全。接着在反应后的溶液中加入过量的NaOH溶液,过滤分离出灰绿色沉淀,该沉淀在空气中加热至质量不变,最后得到1.20g红色粉末。(已知氢氧化锌是两性氢氧化物)
(1)在铁上镀锌的目的是 ;白铁的镀层损伤后,在潮湿的空气环境中首先被腐蚀的金属是 。
(2)实验中,过滤用到的主要仪器是 ,放出气体速率由快变慢的原因是 。
(3)为什么要加入过量NaOH溶液 。
(4)锌在样品中的质量分数是 。
24.(18分)提供下列试剂:①蒸馏水、②用硝酸酸化的AgNO3溶液、③熟石灰、④淀粉、⑤肥皂水、⑥食醋、⑦废干电池(锌筒内填有炭粉、MnO2、NH4Cl、淀粉等的糊状物)、⑧NaCl、⑨Na2CO3 。某同学准备进行下列实验:a.制NaOH b.制Cl2并验证其漂白性 c.制CO2气体 d.制硬脂酸 e.进行淀粉的水解实验并检验其水解产物
(1)由于缺少试剂而不能进行的实验是(不考虑电解) (填代号)。
(2)该同学为制备NH3,先从废干电池中制备NH4Cl。为此,他设想将废电池中的混合物溶于少量的水中,过滤除去不溶物,再蒸发和灼烧滤液,以制得干燥的NH4Cl晶体。他的设想是否合理 (填“合理”或“不合理”),其理由是
。
(3)该同学在做除去淀粉溶液中的氯化钠的实验时,他用一枚鸭蛋自制了一个半透膜小袋,向其中装入混有NaCl的淀粉溶液,扎好袋口。他即将进行的实验操作的名称是
;要保证全部除去淀粉溶液里的食盐,实验中必须
。
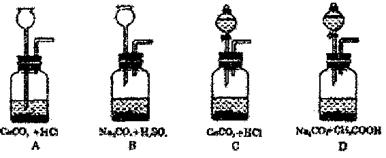
(4)另有同学设计了实验室制取CO2的如下四种实验原理和装置:
|
你认为其中最适合本题所提供的条件的实验原理与装置是 ;理由是
。
(5)由于实验(2)中NH4Cl的制备较困难,且难以满足量的要求,现重瓣提供足量的浓氨水、浓NaOH溶液和NH4Cl晶体,请设计一个最简单的实验,以快速制得NH3。
①你设计的方案是
②请运用化学原理对你的方案予以解释
。
25.(8分)对单质铁溶于稀硝酸的过程如下分析:
(1)当发生的反应Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O时,n(HNO3)与n(Fe)的大小关系为 。(n表示物质的量)
(2)当n(HNO3)≤8n(Fe)/3时,发生反应的离子方程式为
(3)当8n(Fe)/3<n(HNO3)<4n(Fe)时,发生的反应可表示为aFe+bNHO3(稀)=cNO↑+dFe(NO3)2+eFe(NO3)3+fH2O。
现假设a=16,且b、c、d、e、f均为整数,可得到多组化学计量数(系数)的配比,请将它们填入下表(可不填满,也可以补充):
| 组次 | a | B | c | d | e | f |
| 一 | 16 | 11 | 22 | |||
| 二 | 16 | |||||
| 三 | 16 | |||||
| 四 | 16 | |||||
| 五 | 16 | |||||
| 六 |
高三年级第五次月考
化学试卷参考答案
第一卷 选择题 (每小题3分,共54分)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答 案 | C | A | B | B | C | A | C | D | A |
| 题 号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答 案 | B | C | B | A | B | B | B | C | A |
第二卷 非选择题(共56分)
19.(每小题2分,每空1分,共8分)
(1)2;2H++SO42-+Ba2++2OH-====BaSO4↓+2H2O
(2)Fe—2e-=Fe2+; 2H2O+O2+4e-=4OH-
(3)浓盐酸;MnO2+4HCl(浓)=MnCl2+Cl2+2H2O(加热)
(4)防止Hg2+水解生成沉淀;Hg2++2H2O=Hg(OH)2↓(或HgO)+2H+(加热)
|
20.(1) ;(各1分)
(2)CaC2+2H2O=Ca(OH)2+C2H2(2分); (2)CaO+H2O=Ca(OH)2(2分)
21.(每空2分)(1)b;(2)a,d(只选一个且正确,记1分);(3)f
22.(每空2分)(1)1:1;(2)C3H8(g)+5O2(g)===3CO2(g)+4H2O(g); △H=-2044.0kJ/mol
23.(每空1分,共6分)(1)防腐,美观;锌(2)漏斗,烧杯,铁架台,玻璃棒;反应前期,锌与铁形成原电池反应,且锌较活泼,后期,Fe与酸直接作用,反应慢;
(3)利用Zn(OH)2的两性使Zn存在于溶液中,最后得到纯净的Fe2O3; (4)16%
24.(每空2分)(1)b ,e (选一个且正确记1分)(2)不合理;灼烧时氯化铵受热分解
(3)渗析(或透析);在流动的水中进行(或反复多次换水后进行渗析)
(4)D;装置合理,提供了必要的试剂,反应速率合适
(5)①应从试剂选用、装置和收集方法三个方面回答 ②从平衡移动、溶解度随温度变化的角度说明。
25.(1)n(HNO3)≥4n(Fe) (1分)
(2)3Fe+8H++2NO3-=3Fe2++2NO+4H2O (2分)
(3)(每组1分)
| 组次 | a | B | c | d | e | f |
| 一 | 16 | 44 | 11 | 15 | 1 | 22 |
| 二 | 16 | 48 | 12 | 12 | 4 | 24 |
| 三 | 16 | 52 | 13 | 9 | 7 | 26 |
| 四 | 16 | 56 | 14 | 6 | 10 | 28 |
| 五 | 16 | 60 | 15 | 3 | 13 | 30 |
| 六 | 16 |