高三年级化学阶段测试 ( 一 )
化学试卷
命题人 : 何俊
第 1 卷
可能周到的相对原子质量 : H 1 C 12 N 14 O16 Na 23 Al 27 Si 28 S 32
C135.5 Fe 56 Cu 64 Zn 65 Br 80 Ag 108 I 127
一、单项选择题 ( 本题包括 8 小题 , 每小题 4 分 , 共 32 分。每小题只是一个选项符合题 意 )
1. 用即热饭盒盛装食物 , 可以得到热烘烘的饭菜。原因是即热饭盒的底部装入混有镁、 铁粉末的高密度聚乙烯 , 进行简单的操作后水和镁就会发生剧烈的化学反应 , 放出热量便可使食物变热 , 其中铁可能是
A. 一种反应物 B. 催化剂
c. 起导热作用 D. 增大镁与水分子的接触机会
2. 最近广东北江发生严重的水体铺污染事件 , 专家确定用 1200 吨的聚合铁 { 简称 PFS, 化学式为 : [Fe2(OH)n(S04)3-![]() ]m' n<5,m<10} 分批加入 , 利用 PFS 在水体中形成絮状物 ,
]m' n<5,m<10} 分批加入 , 利用 PFS 在水体中形成絮状物 ,
以吸附镉离子。结合题中信息 , 下列说法不正确的是:
A. 10848Cd 核索中中子数为 60
B. 含镉废电池应进行回收处理
C. PFS 中铁显十 2 价
D. 实验室由 FeS04 溶液制 PFS 需经过氧化、水解和聚合的过程
3. 2005 年 10 月 12 日我国成功发射了第二艘载人航夭飞船—— " 神州六号 ", 实现了双人
多天太空旅行。这标志着中国人的太空时代又前进了一大步。发射 " 神六 " 时用肼 (N2H4) 作为火箭发动机的燃料 , NO2 为氧化剂 , 反应生成 N2和水蒸气。
已知 : N2(g) + 202(g) = 2N02(g); ΔH = +67.7kJ/mol
N2H4(g) + 02(g) = N2(g) + 2H20(g); ΔH= -534kJ/mol 下列关于肼和 N02 反应的热化学方程式中 , 正确的是
A 、 2N2H4(g) + 2N02(g) = 3N2(g) + 4H20(I); ΔH = - 11 35.7kJ/mol B 、 2N2H4(g) + 2N02(g) = 3N2(g) + 4H20(g); ΔH= -1000.3kJ/mol c 、 N2H4(g) + N02(g) = 3/2N2(g) + 2H20(l); ΔH = -11 35.7kJ/mol D 、 2N2H4(g) + 2N02(g) = 3N2(g) + 4H20(g); ΔH =-1135.7kJ/mol
4. 测定相对分子质量的常用方法之一是凝回点下降法。例如水是常用的溶剂 , 当水中溶解了某种不挥发的溶质时 ,水的凝固点 (即冰点) 即会下降 , 海水在 0℃时不会结冰就是这个原因。凝固点下降的程度与溶质的分子数有关 ,而与溶质是何种物质无关 , 这就是溶液的依数性。当溶剂的量确定时 , 凝固点的降低值与溶质分子数成正比。己知 10.0 g 樟脑中
溶解 0.412 g萘 , 凝固点下降了13 °C, 即么 , 组成为 C7H602 的有机物 0.23g 溶于 15.6 g 樟脑中 , 凝固点下降约多少 ( 己知萘相对分子质量为 : 128)
A.5 ℃ B.8℃ C.7℃ D.12℃
5. 目前人类已发现的非金属元素除稀有气体外 , 共有 16 种 ,下列对这16种非金属元素的相关判断:
①都是主族元素 , 最外层电子数都大于4
②单质在反应中都只能作氧化剂
③氧化物常温下都是气态 , 所以又叫都气态氢化物
④氧化物常温下都可以与水反应生成酸
A 有①②正确 B. 只有①③正确
C. 只有③④正确 D. ①②③④均不正确
6. .己知 CUS04 溶液分别与 Na2C03 溶液、 Na2S 溶液的反应情况如下 :
(1) CUS04 十 Na2C03 主要 : Cu2+ + C032- H20 ==CU(OH)2 ↓十 CO2 ↑
次要 : Cu2+ + C032- == CuC03 ↓
(2) CUS04 +Na2S 主要 : Cu2+ +S2- == CuS ↓
次要 : Cu2+ + S2- +2H20==Cu(OH)2↓+ H2S ↑
下列几种物质的溶解度大小的比较中 , 正确的是
A. CuS <Cu(OH)2<CuC03 B. CuS >Cu(OH)2>CuC03
C. Cu(OH)2>CuC03>CuS D. Cu(OH)2<CuC03<CuS
7. (NH4)2PtCl6晶体受热分解 , 生成氮气、氯化氢、氯化铵和金属铂。在此分解反应中 , 氧化产物与还原产物的物质的量之比是:
A. 1: 2 B. 1: 3 C. 2: 3 D. 3: 2
8. 下列各选项所述的两个量 , 前者一定大于后者的是:
① F2 和 Br2 的沸点 ②纯水在 25 ℃ 和 80 ℃ 时的 pH 值
③同温下分别在1OOg水中最多能溶解的无水 CuSO5和 CuSO5· 5H2O的质量
④ 25 ℃ 时 ,等体积的 pH 值都等于3的盐酸和 AICL3溶液中 ,已电离的水分子数
⑤在NH3+NO→ N2十H20 反应中 , 被氧化和被还原的 N 原子数
⑥耐火材料 MgO 和 CaO 的熔点
⑦ H-和H+离子半径
⑧金刚石晶体和石墨晶体中 , 每个最小碳环里所含的实际碳原子数
A ①②⑥ B ①②③⑤ C ⑤⑥⑦ D ②⑥⑦
二、不定项选择题 ( 本题包括 8 小题 , 每小题 4 分 , 共 32 分。每小题有一个或两个选项符 合题意。若正确答案只包括一个选项 , 多选时 , 该题为 0 分 : 若正确答案包括两个选项 , 只选一个且正确的得 2 分 , 选两个且都正确的得满分 , 但只要选错一个该小题就为 0 分 ) 9设NA代表阿佛加德罗常数的数值 , 下列说法中正确的是:
①常温常压下, 17g 甲基 (-14CH3) 所含的中子数为9NA
②常温常压 22.4L NO气体的分子数小于NA
③ 64g 的铜发生氧化还原反应 , 一定失去2NA个电子
④常温常压下 , 100mL 0.5mol/L 的乙酸溶液中 , 乙酸的分子数目小于 0.05 NA
⑤标况时 , 22.4L 二氯甲烷所含有的分子数为4NA
⑥常温常压下, 1mol 氯气含有的核外电子数为4NA
A. ①② B. ③④ C ②④ D.⑤⑥
10. 某无色气体可能由 O2 、 CO2 、 HCl、NH3 、NO 、 Br2 中的一种或儿种
组成 , 通过图中洗气瓶后气体体积减少 , 通过干燥管后气体呈红棕色 , 则
下列推断正确的是:
A 干燥管内固体为碱石灰 B 原气体中一定有 NO 和 O2
C. 原气体中一定有NH3 、NO 、CO2 D. 原气体中一定没有 HC1、 Br2
11. 某无色溶液与NH4HC03作用能产生气体,此溶液中可能大量共存的离子组是 A. C1-、 Mg2+ 、H+ 、 Zn2+ 、S042- B. Na+ 、 Ba2+ 、 N03-、 OH- 、 SO42-
C. MnO4-、K+ 、Cl- H+ S042- D. K+ N03-、S042- 、OH- Na+
12 下列各组物质问反应可能包括多步反应 , 其总的离子方程式正确的是 :
A. NaC1O (aq) 中通入少量 CO2: C1O + CO2 + H20 = HClO +HC03
B. FeCI2在空气中被氧化: 4Fe2++O2+2H20=4Fe3++40H-
C. A1CH3(aq)中投入过量Na:A13++4NA+2H20 = A102 + 4Na++ 2H2 ↑
D. FeBr2(aq)中通入少量C12:2Fe2++4Br+3C12= 2Fe3++2Br2+6C1-
13.时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域。测定含 I浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度. 主要步骤如是 :
①在中性溶液中,用溴将试样中l-氧化成lO3- ,将过量的溴除去。
②再加入过量的Kl,在酸性条件下,使lO3-完全转化成l2。
③将②中生成的古典完全萃取后,用肼将其还原成l- ,方程式为:N2H4+2l2= 4l-+N2+ 4H+ ④将生成的l-萃取到水层后用①法处理。
⑤将④得到的溶液加入适量的 KI溶液 ,并用硫酸酸化。
⑥将⑤反应后的溶液以淀粉作指示剂 ,用Na2S203 标准溶液滴定 , 方程式为 :
2Na2S203+l2=Na2S406+2NaI
经过上述放大后,则溶液中I-浓度放大为原溶液中l-浓度的(设放大前后溶液体积相等)
A.2 倍 B.4 倍 C.6 倍 D.36 倍
14.向胶体中加入电解质,能使胶体凝聚。使一定量的胶体在一定时间内开始凝聚所需电解质的浓度(mol/L)称作"聚沉值"。电解质的聚沉值越小,则表示其凝聚能力越大 , 实验证明,凝聚能力主要取决于胶粒带相反电荷的离子所带的电荷数,电荷数越大, 凝聚能力越大,则向Fe(OH)3胶体中加入下列电解质时,其"聚沉值"最小的为:
A. NaCI B. FeCI, C. K2SO4 D. Na3PO4.
15.A不M为两种元素,已知A位于短周期,且A2与M+的电子数之差为8,则下列说法中正确的是:
A. A 和 M 的原子序数之差为 8
B. A 和 M 原子的电子总数之和可能是 11
C. A 和 M 原子的最外层电子数之和为 8
D. A 和 M 原子的最外层电子数之差为 5
 16. 下列关系图中,A是一种正盐 ,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C 外, 另一产物是盐酸盐。
16. 下列关系图中,A是一种正盐 ,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C 外, 另一产物是盐酸盐。
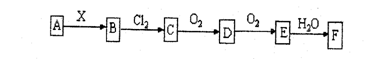
下列说法正确的是:
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和CL2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
第 II 卷
三、 ( 本题包括 2 小题 , 共 22 分 )
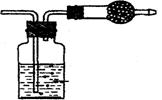
17.(10分)使用常用仪器,运用化学原理进行巧妙的设计,就可以用同一个简单的装
置实现多种用途。


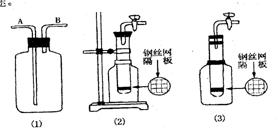
(1)利用上图中(1)装置,用两种不同类的方法分别收集NO,试简述操作方法 :
,
(2) 甲同学把试管底部钻出一小洞 ,并和广口瓶组成上图中(2)装置,通过开、关导管上的阀门可以控制试管内的反应随时发生或随时停止。如果该装置中的隔板是用铜丝制成,则该装置可以制取的常见气体有 。( 至少有两种 )
(3) 乙同学认为,可把(2)装置做如上图(3)的改动,用橡皮塞替代铁架台来固定试管。请判断乙同学的做法是否可行 ?
理由是
18.(12分)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。 2005年的《化学教育》
报道了如下实验研究 :
实验一、定性研究 :
①在试管中加入过量的块状碳酸钙 , 再加入约 20mL 饱和氯水 , 充分反应 , 有少量气
 泡产生 , 溶液浅黄绿色褪去 :
泡产生 , 溶液浅黄绿色褪去 :
②过滤 , 将滤液滴在有色布条上 , 发现其比氯水的漂白性更强 :
③为了确定反应产物 , 将滤液分为三份 , 分别进行以下实验 :
第一份与石灰水混合 , 立即产生大量白色沉淀 :
 第二份与稀盐酸混合,立即产生大量无色气体;将第三份加热,看到溶液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为C02 请问答 :
第二份与稀盐酸混合,立即产生大量无色气体;将第三份加热,看到溶液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为C02 请问答 :
(1) 反应后所得的溶液漂白性增强的原因是
(2) 依据上述实验可推知 , ②的滤液中的溶质除CaCl2、HCIO外,还含有)
实验二、定量研究 :
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙150mL饱和氯水 ,按如图
所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到重筒中的气体不再增加。
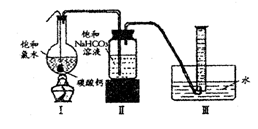
请回答 :
(3)为减少用装置III收集气体过程中CO2因溶解而造成的损失 ,且水槽中仍然为水,请
你对装置 III 进行改进 ,
最简单的方法是
(4) 用改进后的装置进行仁述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到
标准状况下的CO2气体BL,发现![]() 明显小于
明显小于![]() 。若不考虑实验操作和 CO2
。若不考虑实验操作和 CO2
的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是
(5) 实验后发现 ,装置II中的液体增多了,其原因是
四、 ( 本题包括 2 小题 , 共 18 分 )
19. (8 分 ) 己知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:
| NH+4 、Ba2+ 、 Na+ 、H+、SO42-、NO-3、OH-、CO32- |
将这4种溶液分别标记为A、B、C、D
进行如下实验 :
① 在A或D中滴入C,均有沉淀生成
② D和B反应生成的气体能被A吸收
③ A和D反应生成的气体能被B吸收
试回答下列问题 :
(1) D的化学式是 , 判断理由是
(2) 写出其余几种物质的化学式 : A B C
(3) 写出实验②中有关反应的离子方程式
20.(10分)下图是元素周期表中的前四周期 , 回答下列问题 :
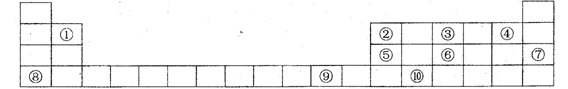
(1)②、④2种元素形成的化合物与⑤的氢化物均为AB3型,但这2种化合物分子的空
间构理明显不同。②、④2种元素形成的化合物分子的空间构型为 ,⑥的氢
化物分子的空间构型为 。 这2种化合物分子空间构型不同的原因是
(2) 元素⑩的单质 (选填"能"、"不能")和强碱溶液反应。如选"能",请写出
元素⑩的单质和强碱溶液反应的离子方程式; 如选 " 不能 ", 请说明理 由
(3)元素⑦和⑨的单质的品体类型分别是 、
五、 ( 本题包括 1 小题 , 共 12 分 )
21. 钨是我国丰产元素 , 是熔点最高的金属 , 广泛用于拉制灯泡的灯丝 , 有 " 光明使者 " 的美誉。
钨在自然界主要以钨 (VI) 酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。 白钨矿的主要成分是钨酸钙 (CaW04); 黑钨矿的主要成分是铁和锰的钨酸盐 , 化学式常写成
(Fe,Mn)W04。黑钨矿传统冶炼工艺的第一阶段是碱熔法 :
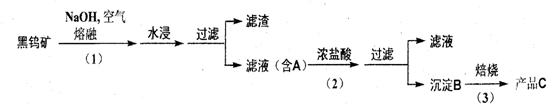
其中 A 、 B 、 C 都是钨的化合物。
(1) 写出上述流程中 A 、 B 、 c 的化学式。
(2) 钨冶炼工艺的第二二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。对钨的纯度
| 要求不高时 , 可用碳作还原剂。写出用碳还原氧化钨制取金属钨的化学方程式。为了获得可以拉制灯丝的高纯度金制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂 ,为什么 ? (3)仲钨酸的阱盐在热分解时会发生内在氧化还原反应 ,我国钨化学研究的奠基人顾冀东先生采用这一反应制得了监色的、非整比的钨氧化物 WO3-x。 这种监色氧化钨具有比表面大、易还原的优点 , 在制钨粉时温度容易控制 ,目前冶炼拉制钨丝的金属钨都用蓝色氧化钨为原料。经分析 , 得知蓝色氧化钨中钨的质量分数为 0.7985。 ①计算 W03-x中的x值。 ②一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态 的钨。试计算蓝色氧化钨中这两种价态的钨原子数比。 ( 相对原子质量 : W: 183.84 0: 16.00) |
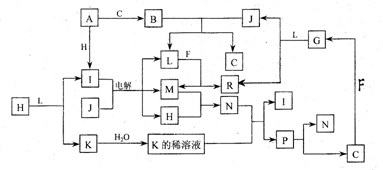
| 六、 ( 本题包括 2 小题 , 共 16 分) 22. (4 分 ) 某共价化合物含 C 、 H 、 N三 元素 , 分子内有 4 个 N 原子 , 且 4 个 N 原子排列 成内空的四面体 ( 如白磷分子结构 ), 每两个 N 原子间都有一个 C 原子 , 分子内无 c-c 单 键和 c=c 双键。 (1) 试确定该化合物的分子式 : (2) 假若某大分子 , 分子内只含 C 、 H 、 P 二种元素 , 其最小的重复的结构单元可以表示为: |
| 23. (12 分 ) 己知 : 下列各种物质都由短周期元素组成 , 它们之间的关系如下图所示。 |
|
|
| 常温1下 ,A 、 F 为金属单质 , F 既能与 L 溶液反应, 又能与 N 溶液反应。 C、 H 、 M 为 |
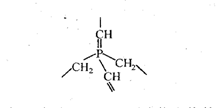
当该化合物分子中含n个磷原子时,则该化合物的组成可表示为:
|
|
| 气体单质 , 其中 H 呈黄绿色 ,A 、 B 、 I 、 K 、 L 、 R 的焰色反应均呈黄色。请回答 : (l)p 的结构式为 ; B 的电子式为 (2)R水溶液呈碱性的原因可用离子方程式表示为 (3)还有一种物质能与B反应生成C.写出这个反应的化学方程式 (4)还有一种物质能与j反应生成C,写出这个反应的化学方程式 (5)某气体Q具有漂白作用,将Q与H等物质的量通入水中所得溶液没有漂白作用 ,写出发生的离子反应方程式
七、(本题包括2小题,共18分) 24. (8 分 ) 将一块部分被氧化的金属钠固体(假设氧化产物只有N202) 入盛满水且倒置水槽内的容器中,此时在容器中可收集到448ML(STP)气体(假定各步反应完全,并产生的所有气被全部被收集到容器中 ), 以电火花引燃容器里的气体 , 最终剩余112ML(STP)气体。求固体中钠及 Na202 的物质的量。 |
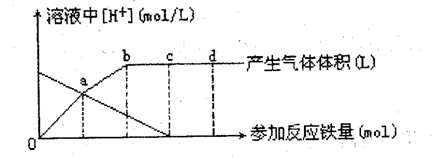
| 25. (10 分 ) 铁与刚 03 作用时 , 还原产物除与刚 03 浓度有关外 , 还与温度有关。己知在 与冷稀由吗 03 反应时 , 主要还原产物为 NO 气体 : 在与热的稀阳吨 03 作用时 , 主要还原 f- 二 吻为 N20 气体 : 当 HN03 更稀时 , 其重要还原产物是 NH4+ 。现有铁与稀丽叶 03 的作用 , 请分析卡因 , 回答有关问题。 |
| 图 10-3 |
| 假设曲线的各段内只有一种还原产物。 (l)a 点到 b 点的还原产物是 ,其原因是
(2) 试完成 b点到c点的反应放程式:□Fe+□HN03-□Fe(N03)3+□□+□H20 (3)反应过程中,到达 点时 HN03 已完全反应。 (4) 己知达到 d 点时,反应结束,此时溶液中的主要阳离子是 (5)c点和d点参加反应的铁的物质的量之比是 |
高三化学阶段测试参考答案
一、单项选择题 ( 本题包括 8 小题 , 每小题 4 分 , 共 32 分。每小题只是一个选项符合题
意 )
1. B 2. C 3. D 4. A 5. D 6. A 7. C 8. D
二、不定项选择题 ( 本题包括 8 小题 , 每小题 4 分 , 共 32 分。每小题有一个或两个选项符 合题意。若正确答案只包括一个选项 , 多选时 , 该题为 0 分 : 若正确答案包括两个选项 , 只选一个旦正确的得 2 分 , 选两个且都正确的得满分 , 但只要选错一个该小题就为 0 分 ) 9. C 10.CD ll.AD 12.C 13.D 14.D 15.BD 16. D.
第 II 卷
三、 ( 本题包括 2 小题 , 共 22 分 )
17. (10 分 )
(1)①广口瓶中盛满水 , NO 从 B 管通入 : ②广口瓶中盛满 CO2 气体 , NO 从 B 管通入
(2)H2 CO2 H2S
(3) 否由于广口瓶被橡皮塞密封后 , 瓶内的气压会随液体的排入而增大 , 使试管中的液
体不能在关闭阀门时排入广口瓶中 , 因而不能使反应随时停止 , 甚至会由于容器中气压过 高而发生危险。
18. (12 分 )
(1) CaC03 消耗了氯水中的 HC1, 使 Cl2+H20===HCI+HCIO 平衡向右移动 , HCIO 浓
度增大 (2 分 )
(2) Ca(HC03)2( 写名称正确同样得分 )(2 分 )
(3) 在导管末端再连接长导管 , 使导管的出口接近量筒底部 (2 分 )
(4) 碳酸钙与氯水反应生成的 Ca(HC03)2 再受热时 , 除生成 CO2 外 , 还生成了 CaC03(3
分 )
(5) 从圆底烧瓶蒸出的水蒸气在广口瓶中冷凝、聚集 (3 分 )
四、 ( 本题包括 2 小题 , 共 18 分 )
19. (8 分 )
( 1) (NH4) 2C03 (1 分 ); D 和 A 、 B 都能生成气体 , 而题给离子中只有 H 一与 ?-CO; 、
OH 一与 NH+4 能反应生成气体 , 故 D 只能为 (NH4) 2C03 (2 分 )
(2) A. H2S04
B. NaOH
C. Ba (N03) 2 ( 每空l分,共3 分 )
(3) NH+4 +OH一 =NH3↑ +H20 NH3+H+ =NH+4(2 分 )
| 20. (10 分 ) (1) 平面三角形 三角锥形 前者分子中中心原子的价电子均参与成键而后者分子中中心 原子上有一对孤对电子未参与成键 (2) 能 Ge+20H- + H20 = Ge032- +2H2 ↑ (3) 分子晶体金属晶体 五、 ( 本题包括 1 小题 , 共 12 分 ) 21. (1)A: Na2W04; B: H2W04 或 W03"H20; C: W03 ( 每个 1 分 , 合计 3 分 ) (2)2 W03 (s) +3C ( 石墨 ) ==2W (s) +3C02 (g) (1 分 , 未配平不得分 ) 因为鸽的熔点很高 , 不容易转变为液态。如果用碳做还原剂 , 混杂在金属中的碳不易除去 , 而且碳会在高温下和金属鸽反应形成碳化鸽 (WC, W2C), 不容易获得纯的金属鸽。用氢 气作还原剂就不存在这些问题。 (2 分 ) (3) ①己知蓝色氧化鸽中鸽的质量分数为 O. 7985; 氧的质量分数即为 : 1-0. 7985=0. 2015 1. OOOg 化合物中含鸽原子和氧原子的量分别为 : n (W) =0. 7985/183. 84=4. 343xl0-3 (mol) n (0) =0. 2015/16. 00=1. 259xl0-2 (mol) 化合物中鸽和氧的计量比为 : n (W): n (0) = 4. 343xl0-3 (mol): 1. 259xl0-2 (mol) =1: 2. 90 (2 分 ) 即在化学式 W03-X 中 : 3-X=2. 90 所以 X 的值为 : X=O. 10 (1 分〉 ②把 +5 价的氧化物和 +6 价鸽的氧化物的化学式分别写成 W02. S 和 W03 设蓝色氧化鸽的组成为 xW O2. S"yW03= W02. 90' 所以有 : x+y=l; 2. 5x+3y=2. 90 解上述联立方程得 : x=O. 20; y=O. 80 (2 分 ) 所以监色氧化鸽中五价和六价鸽的原子数之比为 : n (W) (V): n (W) (VI) =X: y=O. 20: O. 80=1: 4=0. 25 (1 分 ) ( 用其它合理方法计算 , 结果正确者给全分 ) |
| 六、 ( 本题包括 2 小题 , 共 16 分 ) 22. (4 分 ) (l)N 原子构成内空的正四面体构型时 , 正四面体有 6 条棱 , 按所含键合方式 , 则其分子式 为 C6H12N4 。 (2) 每个 P 原子形成 3 个 P-C 单键 ( 其 ? 两个为 "-P-CH2 一 " 一个为 "-P-CH=" 键 ) , 形 成一个 P=C 双键 , 每个 " 一 C 比一 " 以单键结合两个磷原子 , 每 " 一 CH=" 以单双键各结合一 个磷原子。则当 P 原子数为 n 时 ,C 原子数为 2n, H 原子数为 3n, 即组成式为 C2nH3nPn 。 |
(3)2C02 + 2Na202 = 2Na2C03 + O2 (1)2F2 + 2H20 = 4HF + O2
(5)S02 + Ch + 2H20 = 4H+ + 2Cl- + sol 一
七、 ( 本题包括 2 小题 , 共 18 分 )
24. (8 分 )
解 : 整个过程涉及到的化学反应有 :
① 2Na+2H20==2NaOH+H2
② 2Na202 十 2H20 ===4NaOH+ O2
由题意可知 , 剩余的气体可能是氧气 , 也可能是氢气 , 剩余气体的物质的量为 112X 10- 3 L/22.4L==0.005mol 。
参加③反应的氢气和 l 氧气为 448mL-112mL==336 mL, 所以参加③反应比不 II 02 的物质的量 分别为 :
n(Hz)== C336X2/3X10-3 L) /22. 4L==0. 01mol
n(Oz)== C336Xl/3XlO-3 L) /22. 4L==0. 005mol
若剩余气体为氢气 , 即①反应生成的氢气为 0.01mol+0.005mol=0.015mol, ②生成的氧气 为 O. 005mol, 所以
由方程式①和②可以求山 Na 和 NazOz 的物质的量分别为 :
n (Na) ==0.Ol5mol X 2==0. 03mol
n (NazOz) =0. 005mol X 2==0. 01mol
若剩余气体为氧气 , 即①反应生成的氢气为 O. Olmol , ②生成的氧气为 O.005mol++0.005mol=0.01mol, 所以
由方程式①手 n ②可以求出 Na 和 Na202 的物质的量分别为 :
n (Na) ==O.Olmol X 2==0. 02mol
n (NazOz) O. Olmol X 2==0. 02mol
所以 , 被氧化的金属纳中 Na 及 Na202 物质的量 0.03mol 不 n O. 01mol, 或各 0.02molo
25. (10 分 )
(1) NzO , 反应放热 , 使溶液温度升高
(2) 8, 30, 8, 3NH4N03, 9 (3)C (1)Fez+ (5)2: 3