高三年级九校第一次联考化学试卷
化 学 试 卷
第Ⅰ卷(选择题 共74分)
可能用到的相对原子质量:H 1 O 16 Na 23 Mg 24 Al 27 C1 35.5 K 39
Ca 40 Fe 56 Cu 64
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是
A.同系物 B.同分异构体 C.同位素 D.同素异形体
2.上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。下列关于NO的说法不正确的是
A.NO分子中有极性共价键 B.NO是造成光化学烟雾的因素之一
C.NO是汽车尾气的有害成分之一 D.NO分子所含电子总数为偶数
3.pH相同的盐酸和醋酸两种溶液,它们的
A.H+的物质的量相同 B.H+的物质的量浓度相同
C.溶质的物质的量相同 D.溶质的物质的量浓度相同
4.进行下列实验肯定能获得成功的是
A.用1mol/L的盐酸与MnO2反应制取氯气
B.用湿润的淀粉碘化钾试纸鉴别二氧化氮和溴蒸气
C. 用10mL量筒准确量8.50mL稀硫酸
D.用热的浓纯碱溶液去除管壁内壁附着的油脂
5.下列现象或应用不能用胶体知识解释的是
A.氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体
B.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
C.水泥、冶金厂常用高压电除去工厂烟尘,以减少对空气污染
D.牛油与烧碱溶液共煮,向反应后所得的溶液中加入食盐,则有固体析出
6.吊白块学名为甲醛次硫酸氢钠(NaO—CH2—SO3H),它能使粉丝漂白,但在粉丝中残留甲醛等有毒物质,严重危害人体健康。它可由NaHSO3和HCHO在一定条件下反应制得: NaHSO3+HCHO→NaO—CH2一SO3H。该反应的类型是
A.取代反应 B.加成反应 C.聚合反应 D.消去反应
7.下列离子组在pH=0的溶液里能大量共存的是
A.Na+、Fe2+、Cl—、NO3— B.K+、Al3+、HCO3—、SO42—
C.NH4十、Mg2十、Br—、SO42— D.K十、Na+、S2—、SO3 2一.
8.下列离子方程式书写正确的是
![]() A.碳酸钠溶液显碱性:CO32- + 2H2O H2CO3
+2OH-
A.碳酸钠溶液显碱性:CO32- + 2H2O H2CO3
+2OH-
B.氯化铝溶液中加入偏铝酸钠溶液:Al3+ +3AlO2- +6H2O= 4Al(OH)3 ↓
C.氨气通入碳酸氢钠溶液中:NH3 +H+ = NH4+
D.碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
二、选择题(本题包括10小题,第9—16题每小题4分,第17—18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为。分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.军事上的“地表伪装’’是军事上保护的外观色彩、红外反射与环境吻合。BASF是新型红外伪装还原染料,为橄榄色或黑色。其化学结构如下:
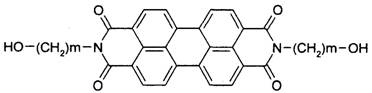
1mol该物质与钠在一定条件下反应,产生氢气量以及在催化剂作用下加成所需氢气物质的量,最大值分别为
A.1 mol,7 mol B.2 mol,10 mol C.1 mol,14 mol D.2 mol,14mol
10.铝、铍(Be)及其化合物具有相似的化学性质,如其氯化物分子内键型相同,故其氯化物晶体的熔点都较低。已知反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是
A.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO
B.BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO
C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
D.BeCl2水溶液的导电性强,故BeCl2是离子化合物
11.实验测得常温下0.1 mol/L某一元酸(HA)溶液的pH不等于l,0.1 mol/L某一元碱(BOH)溶液里:
C(H+)/C(OH—)=10—12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是
A.C(B+)>C(A—)>C(OH—)>C(H+) B.C(A—)>C(B+)>C(H+)>C(OH—)
C.C(B+)+C (H+)=C(A—)+C(OH—) D.C(B+)>C(A—)>C(H+)>c(OH—)
12.设NA为阿伏加德罗常数,下列叙述中正确的是
A.1 L lmol/L醋酸溶液中离子总数为2NA
B.标准状况下22.4 L H2中含中子数为2NA
C.46 gNO2和N2O4混合气体中含有原子数为3NA
D.2mol钠与足量氧气在不同条件下反应生成Na2O或Na2O2均失去2NA个电子
13.某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为
A.11.2 g B.16.8 g C.19.6 g D.22.4 g
14.X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应分子的是
A.② B.②④ C②⑤⑥ D.①②③④
15.已知:t℃时,某物质的不饱和溶液ag中含溶质mg。若溶液蒸发bg水并恢复到t℃时,析出溶质m1g;若原溶液蒸发cg水并恢复到t℃时,则析出溶质m2g。若用S表示该物质在t℃时的溶解度,下式中正确的是
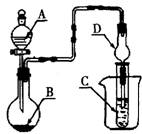

16.如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液变浑浊
C.若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀后沉淀又溶解
![]() D.实验仪器D可以起到防止溶液倒吸的作用
D.实验仪器D可以起到防止溶液倒吸的作用
17.在一个固定体积的密闭容器中,加入2 molA和1 molB发生如下反应:2A(g)+B(g) 3C(g)十D(s),达到平衡时C的浓度为1.2 mol/L。若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2 mol/L的是
A.4 mol A十2 mol B B.3 mol C+1 mol D+l mol B
C.3 mol C十0.8 m01 D D.1.6 mol A+0.8 mol B+0.6 mol C+0.3 mol D
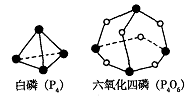 18.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P—P 198KJ·mol—1、P—O 360kJ·mol—1、氧气分子内氧原子间的键能为498kJ·mol—1则P4+3O2==P4O6的反应热△H为
18.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P—P 198KJ·mol—1、P—O 360kJ·mol—1、氧气分子内氧原子间的键能为498kJ·mol—1则P4+3O2==P4O6的反应热△H为
A.+1638 kJ·mol—1 B.一1638 kJ·mol—1
C.一126 kJ·mol—1 D.十126 kJ·mol—1
第Ⅱ卷(非选择题共76分)
三、(本题包括2小题,共20分)
19.(8分)下列有关化学实验的操作或说法中,正确的是(填字母序号) 。
A.过滤、蒸发操作过程中都需要用玻璃棒不断搅拌液体。
B.将pH试纸置于表面皿上,用玻璃棒蘸取溶液点在pH试纸的中部,在30s内与对应的标准比色卡比较,即可测出该溶液的pH。
C.中和滴定实验中,锥形瓶内有少量蒸馏水会造成测定结果偏低。
D.在进行硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行4次。
E.制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸干滤液即可得硫酸亚铁晶体。
F.向2mLl0%NaOH溶液中滴入2%CuS04溶液的4—6滴,振荡后加入乙醛溶液0.5
mL,加热至沸腾,则有红色沉淀出现。
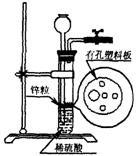 20.(12分)右图是一种实验室常用的气体发生装置的示意图。请回答下列问题:
20.(12分)右图是一种实验室常用的气体发生装置的示意图。请回答下列问题:
(1)简要回答如何检查该装置的气密性
(2)实验中出现下列情况,试简答如何处理。
a.若液面刚好不与锌粒接触,而又不增加酸液,如何使反应发生? 答:
b.若液面已盖没锌粒且气密性良好,却收集不到气体,其原因可能是 处理方法为 。
(3)若实验室只有下列仪器用品,请从中选择合适仪器组装一套能随开随用、随关随停的氢气发生装置。你认为必须选择的仪器是(填下图中的字母序号);
。
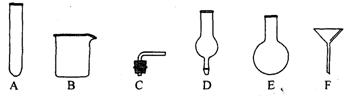
(4)请利用下图U形管设计并绘制一套“随开随用、随关随停”的氢气发生装置(其它仪器自选)
![]()
四、(本题包括2小题,共20分)
21.(10分)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿仑尼乌斯(Arrhenius)提出了的电离理论。
(1)1905年富兰克林(Franklin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出液氨自身弱电离的方程式: 。
(2)1923年丹麦化学家布朗斯物(Brφusted)和英国化学家劳莱(Lowry)提出了质子论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论:下列粒子在水溶液既可看作酸又可看作碱的是 。
A.H2O B.NH4+ C.OH- D.HCO3- E.CH3COO- F.Cl-
(3)1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如:
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+
+
[∶OH ]— ![]() H∶OH
H∶OH
试指出下列两个反应中的酸或碱
① H3BO3 + H2O = H+ + B(OH)4- 该反应中的碱是 (填:H3BO3 或 H2O)
② NaH + H2O = NaOH +H2↑ 该反应中的酸是 (填:NaH 或 H2O)
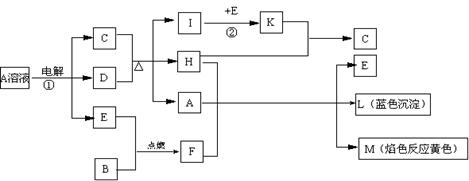 22.(10分)已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体。根据下列关系,试回答:
22.(10分)已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体。根据下列关系,试回答:
(1)L的化学式: F的电子式: 。
(2)反应①的离子方程式: 。
(3)反应②,工业上采取的反应条件: 。
(4)每生成1molK,反应放出98.3kJ热量,该反应的热化学方程式为:
。
五.(本题包括2小题,共18分)
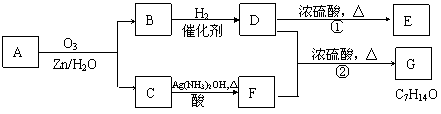
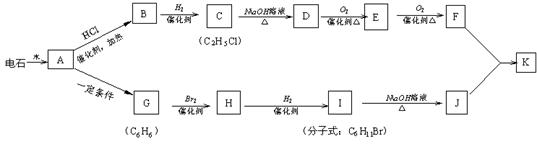 23.(10分) 已知A-K是中学化学中常见有机物,其中G不能使酸性高锰酸钾溶液褪色,他们之间有如下关系。试回答:
23.(10分) 已知A-K是中学化学中常见有机物,其中G不能使酸性高锰酸钾溶液褪色,他们之间有如下关系。试回答:
(1)写出实验室制取A的化学方程式: ;
(2)写出D→E的化学方程式: ;
(3)B在一定条件下可合成一种重要的塑料,写出该合成反应的方程式:
;
(4)写出酯K的结构简式: ;
(5)在物质A-K中与等物质的量的A完全燃烧消耗O2相同的有机物是 (填序号A…)
24.(8分) 烯烃通过臭氧化并经锌和水处理得到醛或酮,例如:
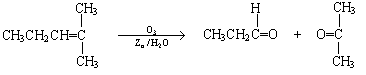 |
一种链状单烯烃A通过臭氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。其转化关系如下;
 |
请回答下列问题:
(1)B的相对分子质量是__________________。
(2)写出结构简式:A__________________、E_______________________。
(3)写出反应①、②的反应类型:①________________、②_______________。
(4)写出反应②的化学方程式:______________________________________。
六、(本题包括2小题,共18分)
25.(8分)在10mL硫酸和硫酸钾的混合溶液中,硫酸的物质的量浓度为1.6mol/L,硫酸钾的物质的量浓度为3.0mol/L。欲使硫酸的浓度变为2.0mol/L,硫酸钾的浓度变为0.30mol/L,现用98%的浓硫酸(ρ=1.84 g·cm—3)和蒸馏水进行配制。试求需要取用浓硫酸的体积。
26.(10分)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜的质量分数为x,试回答下列。
(1)所得硫酸铜晶体的质量y为: g(用x表示);
(2)若x =0.4,混酸中HNO3与H2SO4的物质的量之比为: ;
(3)若x=0.4,480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4·5H2O,试求原混酸中H2SO4的质量分数。
参 考 答 案
第Ⅰ卷(选择题 共74分)
1、D 2、D 3、B 4、D 5、A 6、B 7、C 8、B 9、C 10、B C
11、AC 12、CD 13、A 14、D 15、C 16、BD 17、D 18、B
第Ⅱ卷(选择题 共76分)

四、(18分)
21.(8分,每空2分)(1)2NH3 ![]() NH4+ + NH2-
NH4+ + NH2-
(2)AD (3)H2O;H2O
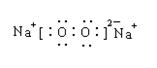 22.(10分,每空2分)
22.(10分,每空2分)
(1) Cu(OH)2 ;
![]() (2)2Cu2+ +2H2O
2Cu↓ +O2 ↑+4H+
(2)2Cu2+ +2H2O
2Cu↓ +O2 ↑+4H+
(3)常压,催化剂,400-500oC (答出催化剂和加热即可)
(4)SO2(g)
+ 1/2 O2(g) ![]() SO3(g);△H=-98.3kJ/mol
SO3(g);△H=-98.3kJ/mol
五、(18分)
23. (共10分,每空均2分)(1)CaC2 +2H2O →Ca(OH)2 + C2H2 ↑
(2)2CH3CH2OH
+ O2 ![]() 2CH3CHO +2H2O
2CH3CHO +2H2O
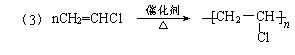
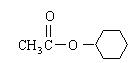
(4) (5)BD(未选B不扣分)
24、 (1)86
(2)A:(CH3CH2)2C=CHCH3 E:CH3CH=CHCH2CH3
(3)①消去反应 ②酯化(取代)反应
(4)CH3COOH+CH3CH2CH(OH)CH2CH3![]() CH3COOCH(CH2CH3)2+H2O
CH3COOCH(CH2CH3)2+H2O

26.(10分)(1)(3分)375x + 1500 [(写成250×(![]() )]
不扣分)
)]
不扣分)
(2)(3分)1∶3.3 (3)(4分)
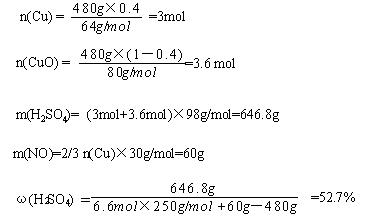 (结果在52%-53%不扣分,其余不给分)
(结果在52%-53%不扣分,其余不给分)