高三年级统一考试化学试卷
相对原子质量:H:1 C:12 Na:23 Si:28 S:32 Cl:35.5 Fe:56
一、选择题(每小题只有一个选项符合题意)
1. 下列实际应用与胶体知识无关的是( )
A. 工业制取有色玻璃 B. 明矾净水
C. 冶金工业用高压电除尘 D. 离子交换膜法制烧碱
2. 下列说法不正确的是( )
A. 胶体能发生电泳现象是由于胶体粒子带电
B. 16O与18O互为同位素;H216O、D216O互为同素异形体
C. 在SiO2晶体中,1个Si原子和4个O原子形成4个共价键
D. 工业制硫酸的主要设备按反应先后依次是沸腾炉、接触室、吸收塔
3. 下列叙述正确的是( )
A. 共价化合物中各原子都形成8电子稳定结构
B. 物质导电均为物理变化
C. 两种元素组成的离子化合物中一定不含非极性键
D. 由一种分子构成的物质一定是纯净物
4. 下列各组物质中,按熔点由低到高排列正确的是( )
A. ![]() B.
B.
![]()
C. ![]() D.
D.
![]()
5. 目前,科学界拟合成一种“双重结构”的球形分子,即把足球烯C60的分子容纳在Si60分子中,外面的硅原子与里面的碳原子以共价键结合,下列叙述错误的是( )
A. 该晶体属分子晶体 B. 该分子内原子间都以极性共价键相连接
C. 该物质是一种新化合物 D. 该物质的相对分子质量为2400
6. 有关化学用语正确的是( )
A. 次氯酸的结构式![]()
B. 硫离子结构示意图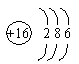
C. 羟基的电子式![]()
D. 四氯化碳的电子式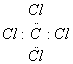
7. 最近,医学界通过用放射性14C标记的C60,发现一种C60的羧酸衍生物在特定条件下,可通过断裂DNA杀死细胞,从而抑制艾滋病。有关14C的下列叙述中正确的是( )
A. 14C与普通碳原子的化学性质不同
B. 14C与14N含有的中子数相同
C. 14C是金刚石的同素异形体
D. 14C与12C互为同位素
8. 已知31g白磷变成红磷放出18.39kJ热量,下列两反应中( )
![]()
![]()
则Q1和Q2的关系是( )
A. ![]() B.
B.
![]() C.
C.
![]() D.
无法确定
D.
无法确定
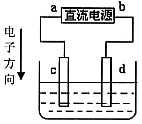
9. 下图是电解![]() 溶液的装置,其中c、d为石墨电极。则下列有关判断正确的是( )
溶液的装置,其中c、d为石墨电极。则下列有关判断正确的是( )
A. a为正极、b为负极
B. c为阳极、d为阴极
C. 电解过程中,c电极质量增加
D. 电解过程中,氯离子浓度不变
10. 某物质经分析,只含有一种元素,则此物质( )
A. 一定是一种单质
B. 一定是纯净物
C. 一定是混合物
D. 可能是纯净物,也可能是混合物
11. 在pH=1的无色溶液中,下列离子能大量共存的是( )
A. ![]() B.
B.
![]()
C. ![]() D.
D.
![]()
12. 已知KH和H2O反应生成H2和KOH,则反应中1mol KH将( )
A. 失去1 mol电子 B. 得到1 mol电子
C. 失去2 mol电子 D. 没有电子得失
13. 下列离子方程式正确的是( )
A. 氯化铁溶液中通入碘化氢气体:![]()
B. 稀硝酸除银镜:![]()
C. 苯酚钠溶于醋酸溶液:![]()
D. 氯化亚铁溶液中通入少量氯气:![]()
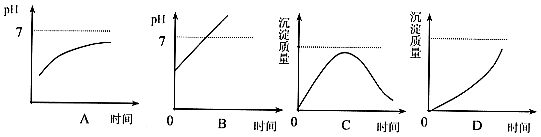
14. 用石墨作电极电解![]() 溶液时,下图所示的电解液变化曲线中合理的是(不考虑
溶液时,下图所示的电解液变化曲线中合理的是(不考虑![]() 的溶解对溶液pH的影响)( )
的溶解对溶液pH的影响)( )
15. 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:
![]()
![]()
![]()
下列叙述不正确的是( )
A. 放电时负极反应为:![]()
B. 充电时阳极反应为:![]()
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时阴离子向负极移动
二. 填空题:
16. 按下图进行实验,写出有关的电极反应式:
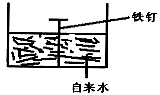
负极_________________,正极__________________。
17. 化合物A是一种不稳定的物质,可以用![]() 表示,10mL A(g)能分解生成15mL O2和10mL F2(同温同压下),由此可以推断:
表示,10mL A(g)能分解生成15mL O2和10mL F2(同温同压下),由此可以推断:
(1)A的化学式为_________,推断的依据是:__________________;
(2)已知A的分子中的X个原子呈…O—O—O…键状排列,则A分子的电子式为__________________。
18. 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与形成新化学键的键能之和的差。
| 化学键 | Si-F | Si-Cl | H-H | Cl-Cl | H-Cl | Si-Si | Si-C |
| 键能/kJ·mol-1 | 540 | 360 | 436 | 243 | 431 | 176 | 347 |
已知硅的卤化物(SiX4)的熔点比钠的卤化物(NaX)的熔点低得多。
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC_________Si;SiF4_________SiCl4;
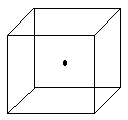
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子;
(3)工业上可通过氢气和氯气点燃来制取氯化氢,写出该反应的热化学方程式_____________________________________________。
19. 有一瓶澄清溶液,其中可能含有![]() 和
和![]() 。取该溶液进行如下实验:
。取该溶液进行如下实验:
①用pH试纸检验,溶液呈强酸性
②取部分溶液,加入少量CCl4及数滴新制的氯水,振荡后静置,CCl4层呈紫红色
③另取部分溶液,逐滴加入稀氢氧化钠溶液,使溶液从酸性逐渐变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④取上述碱性溶液,加入碳酸氢钠溶液,有白色沉淀生成
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝
根据上述实验事实确定:
(1)该溶液中肯定存在的离子有__________________。
(2)不能确定是否存在的离子有__________________。
20. 某一反应体系有反应物和生成物共五种物质:
![]()
已知该反应中![]() 只发生如下过程:
只发生如下过程:![]()
(1)该反应中的还原剂是_________;
(2)该反应中,发生还原反应的过程是__________________→__________________;
(3)写出该反应的化学方程式,并标出电子转移的方向和数目__________________;
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为_________L。
21. X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物。
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的电子式是______________________________________________________;
(2)Z2Y2与X2Y反应的化学方程式是____________________________________;
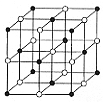
(3)ZW晶体的单元结构如下图所示,晶体中距离最近的Z+和W-的核间距离a cm,已知阿伏加德罗常数为![]() ,其密度为
,其密度为![]() ,则ZW的摩尔质量可表示为__________g/mol;
,则ZW的摩尔质量可表示为__________g/mol;
(4)如下图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(I)、C(II)为多孔石墨电极。接通S1后,C(I)附近溶液变红,两玻璃管中有气体生成。此时:
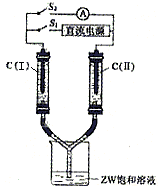
C(I)为________极,该电极反应式为____________________,
电解的总反应的离子方程式为____________________;
(5)接通S1一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)为__________极,
C(II)的电极反应式为______________________________。
三. 实验题
22. 利用下列所给实验用品:①Fe电极②石墨电极③![]() ④
④![]() ⑤
⑤![]() ⑥导线⑦直流电源(负极在左,正极在右),各设计一种能够实现下列反应的装置(相关内容请用序号填空):
⑥导线⑦直流电源(负极在左,正极在右),各设计一种能够实现下列反应的装置(相关内容请用序号填空):
(1)![]()
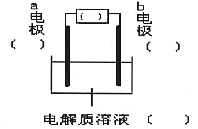
(2)![]()
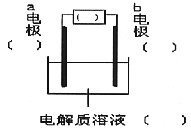
四. 计算题
23. 工业用接触法制硫酸,请回答下列问题:
(1)接触室中生成![]() 反应条件的选择,可以完全用勒夏特列原理解释的是______。
反应条件的选择,可以完全用勒夏特列原理解释的是______。
A. 用V2O5作催化剂 B. 温度为400℃—500℃
C. 常压 D. O2过量
(2)在硫酸工业的尾气中,__________是主要大气污染物,必须进行净化处理,处理方法可用过量氨水吸收,反应的离子方程式是______________________________。
(3)用含![]() 的黄铁矿100t,如果在锻烧过程中
的黄铁矿100t,如果在锻烧过程中![]() 损失了18%,则可生产质量分数为98%的硫酸多少吨?请写出计算步骤。
损失了18%,则可生产质量分数为98%的硫酸多少吨?请写出计算步骤。