高三上学期化学检测试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至4页,第Ⅱ卷5至8页,满分100分,考试时间90分钟。
注意事项:
1.答第Ⅰ卷时,答案填在第Ⅱ卷卷首答题栏内。
2.请在第Ⅱ卷登分栏下面的座位号方格内工整地填写好座位号,考试结束后,只交第Ⅱ卷。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23
Al 27 S 32 Fe 56 Cu 64 Ag 108
第Ⅰ卷(选择题,共44分)
一、选择题(本大题共22小题,每小题2分,共44分。在每小题给出的四个选项中
只有一项是符合题意的,将符合题意的答案前面的字母填入第Ⅱ卷卷首答题栏内。)
1.19世纪中叶,俄国科学家门捷列夫的突出贡献是
A.提出了原子学说 B.提出了相对论
C.提出了分子学说 D.发现了元素周期律
2.下列说法中,你认为不科学的是
A.食用含碘食盐可预防甲状腺肿大
B.使用含氟牙膏可预防龋齿
C.绿色食品是指不含任何化学物质的食品
D.光导纤维是以二氧化硅为主要原料制成的高性能通讯材料
3.旨在限制温室气体排放、抑制全球气候变暖的《京都议定书》,已于2005年正式生效。为减少二氧化碳这种温室气体的排放,下列措施不切实际的是
A.大力开发氢能源 B.充分利用太阳能
C.不使用含碳燃料 D.提高能源利用率
4.我国科学家前不久成功合成了3mm长的管状定向碳纤维纳米管,长度居世界之首。下列对碳纤维的说法不正确的是
A. 主要组成元素是碳 B. 结构与石墨不同
C. 是一种新型无机非金属材料 D. 是一种高分子化合物
5.上海某医院研究用放射性碘 治疗肿瘤。该核素核内的中子数为
A.19 B.53 C.72 D.125
6.以石灰石、食盐、水和空气为主要原料,能生产的化工产品是
A. 硫酸 B. 烧碱 C. 过磷酸钙 D. 玻璃
7.下列表达式正确的是
![]() A.
HCO3-的电离方程式 HCO3- H+
+ CO32-
A.
HCO3-的电离方程式 HCO3- H+
+ CO32-
![]()
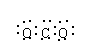 B.
HS-的水解方程式 HS- + H2O H3O+
+ S2-
B.
HS-的水解方程式 HS- + H2O H3O+
+ S2-
C. 二氧化碳分子的电子式
D.次氯酸分子的结构式 H—Cl—O
8.下列离子方程式正确的是
A.硫化亚铁加入盐酸中 S2- + 2H+ == H2S↑
B.硫酸铜溶液中通入硫化氢 Cu2+ + H2S == CuS↓ + 2H+
C.氯化铝溶液中加入过量氨水 Al3+ + 4NH3·H2O== AlO2- + 4NH4+ + 2H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3- + OH-== CO32- + H2O
9.常温下,由水电离出来的c(H+) = 10-13 mol·L-1的溶液中,下列各组离子一定能大量共存的是
A.K+、Ba2+、Cl-、NO3- B.Na+、AlO2-、S2-、PO43-
C.NH4+、Fe3+、Br-、SO42- D.Fe2+、Cu2+、Mg2+、NO3-
10.100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.1 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为(假定混合后溶液体积不变)
A.0.2 mol·L-1 B.0.25 mol·L-1 C.0.3 mol·L-1 D.0.6 mol·L-1
11.在盛有饱和Na2CO3溶液的烧杯中,插入惰性电极,保持温度不变,通电一段时间后,下列判断正确的是
A.溶液的pH将增大 B.Na+数和CO32-数的比值将变小
C.溶液浓度不变,有晶体析出 D.溶液浓度增大,有晶体析出
12.下列提纯物质的方法正确的是
A.除去NO2中的NO:将气体与过量O2混合
B.除去CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸
C.除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤
D.除去乙酸中的乙醇:向混合液中加入生石灰后蒸馏
13.下列说法不正确的是(标准状况)
A.1 mol水的体积约为22.4 L
B.28g N2和CO的混合气体体积约为22.4 L
C.1 mol H2的体积约为22.4 L
D.NA个HCl分子所占的体积约为22.4 L
![]() 14. 反应 A(g)+3B(g) 2C(g)+2D(g) 在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
14. 反应 A(g)+3B(g) 2C(g)+2D(g) 在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
A. v(A) = 0.15mol·(L·min) -1 B. v(B) = 0.5mol·(L·min) -1
C. v(C) = 0.3mol·(L·min) -1 D. v(D) = 0.4mol·(L·min) -1
15.下列各组物质的溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是
A.NaHSO4和Ba(OH)2 B.Na2CO3和稀HCl
C.NaAlO2和H2SO4 D.Al2 (SO4)3和NaOH
16.下列说法正确的是
A. 粒子半径:Na+>O2->F- B.稳定性:HF<H2O <NH3
C. 熔点:金刚石>晶体硅>SiC D.密度:浓硫酸>水>汽油
17.用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,已知溶液中的
c(CN-)<c(Na+),下列关系式正确的是
A.c(H+) > c(OH-) B.c(HCN) > c(CN-)
C.c(CN-) + c(OH-) = 0.1mol·L-1 D.c(HCN) + c(CN-) = 0.1mol·L-1
18.从化合物香兰素(![]() )的结构简式推测,它不具有的化学性质是
)的结构简式推测,它不具有的化学性质是
A.与银氨溶液反应 B.与FeCl3溶液反应
C.可以燃烧 D.可与NaHCO3溶液反应放出CO2
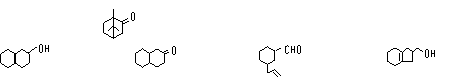 |
19. 樟脑结构式可表示为 (分子式C10H16O),下列与樟脑不属于同分异构体的是
A. B. C. D.
20.臭氧具有强氧化性,可使湿润的碘化钾淀粉试纸变蓝,有关反应如下:
O3 + 2KI + H2O = 2KOH + I2 + O2 ,对此反应的说法正确的是
A. 1 molO3得2 mol电子
B. O3是氧化剂,KI 和H2O是还原剂
C. 氧化产物I2与还原产物O2的物质的量之比为1∶1
D. 由此反应可知,氧化性强弱顺序为O3>I2>O2
21.将14g铜银合金与足量某浓度的硝酸溶液反应,放出的气体与1.12L(标准状况)氧气混合后,恰好能全部被水吸收,则合金中铜的质量是
A. 1.6g B. 3.2g C. 6.4g D. 9.6g
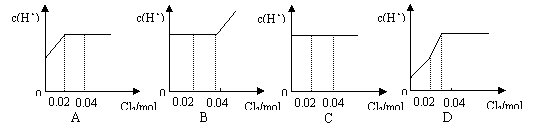
22.将0.03mol Cl2缓缓通入含0.02mol H2SO3和0.02molHBr的溶液中,在此过程中,溶液中的c(H+)与Cl2用量的关系示意图是(假设溶液的体积不变)
上学期高三检测试卷
| 得分 | 评卷人 |
化 学
第Ⅰ卷答题处(请将正确答案前面的字母填入下表相应的空格内)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
登分栏
| 题号 | 第Ⅰ卷 | 二 | 三 | 四 | 五 | 总分 |
| 得分 |
| 得分 | 评卷人 |
| 座位号 | |
第Ⅱ卷(非选择题,共56分)
二、(本题包括3小题,共21分)
23.(6分)现有甲、乙、丙、丁四个集气瓶,分别装有H2、O2、Cl2、HCl气体。其中甲是有色气体;打开乙的瓶盖,瓶口上方会出现白雾;甲和丁混合见光爆炸。根据上述现象推断
(1)甲是 ,丙是 。
(2)上述四种气体分子中 是极性分子。
![]() 24.(7分)通过实验测得下列数据:
24.(7分)通过实验测得下列数据:
| MgO | Al2O3 | MgCl2 | AlCl3 | |
| 熔点 / ℃ | 2852 | 2072 | 714 | 190 |
| 沸点 / ℃ | 3600 | 2980 | 1412 | 183 |
回答:
(1)MgCl2的晶体类型 。
(2)工业上常用电解熔融MgCl2的方法制金属镁,电解Al2O3的方法制金属铝,请写出其中任意一个制备的化学方程式 。
(3)请分析此表中的数据来提出一个探究的问题
。
25.(8分)已知A是一种常见的单质气体,X是一种淡黄色的固体,Y是一种常见的液体,Z是一种有刺激性气味、极易溶于水的气体。有关的转化关系如下(反应条件均已略去):
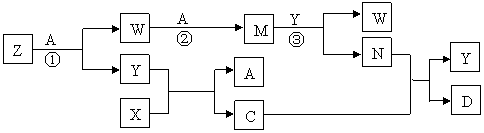 |
回答下列问题:
(1)写出X的化学式 ;Y的电子式 。
(2)Z与N反应生成化合物的水溶液呈 (填“酸性”、“中性”、“碱性”)。
(3)请写出C的稀溶液与N的稀溶液反应的热化学方程式(已知中和热为57.3kJ· mol-1) 。
| 得分 | 评卷人 |
三、(本题共2小题,共11分)
26. (2分)下列实验中所选仪器不合理的是 。
A.用200mL量筒量取5.2mL稀硫酸溶液
B.用250mL容量瓶配制250mL0.2 mol·L-1的氢氧化钠溶液
C.用托盘天平称取11.7g氯化钠固体
27.(9分) 按如图所示装置进行铜与稀硝酸反应的实验。请回答:
(1)仪器A的名称 。
 (2)在不时摇动A的条件下,使反应充分进行。可观察到四个主要现象:
(2)在不时摇动A的条件下,使反应充分进行。可观察到四个主要现象:
①气球时大时小,最后变小;
②铜丝逐渐变细(但最终未完全消失),且表面有气泡生成;
③ ;
④ 。
(3)实验过程中,触摸A外壁的感觉是 。
(4)在摇动A的条件下,导致气球变小的化学方程式为
。
| 得分 | 评卷人 |
四、(本题共2小题,共14分)
28.(8分)2005年冬,吉林石化的两个储藏罐发生意外,起火爆炸。如不及时灭火,可能危及附近的苯储藏罐,极有可能造成更大爆炸;如灭火不当,已爆炸破损的储藏罐流出的苯、硝基苯等会造成重大环境污染。
(1)通常状况下,苯是难溶于水、密度比水 的液体;硝基苯是
有 气味的有毒物质。
(2)实验室制硝基苯的化学方程式为 。
(3)如果你是现场灭火指挥,应决定用 灭火。
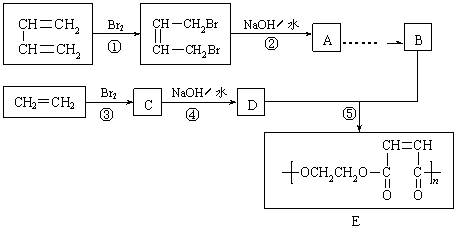
29.(6分)用石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列途径合成高分子化合物E。E可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
 |
请回答:
(1)反应④的反应类型________________。
(2)A的结构简式_______________________。
(3)反应③的化学方程式
___________________________________________。
| 得分 | 评卷人 |
![]() 五、(本题共2小题,共10分)
五、(本题共2小题,共10分)
![]() 30.(4分)酒度是指酒中所含乙醇的体积百分比,如 (1%)酒是1体积乙醇和99体积水的混合溶液。已知水和乙醇的密度分别为1.0g·cm-3和0.8g·cm-3。试计算 (52%)“德山大曲”白酒中乙醇的质量分数。
30.(4分)酒度是指酒中所含乙醇的体积百分比,如 (1%)酒是1体积乙醇和99体积水的混合溶液。已知水和乙醇的密度分别为1.0g·cm-3和0.8g·cm-3。试计算 (52%)“德山大曲”白酒中乙醇的质量分数。
31.(6分)现有6.95 g Fe、Al混合物溶解在200 mL某浓度的稀硝酸中。当金属粉末完全溶解时,收集到3.36L 的NO气体(标准状况)。在反应后的溶液中逐滴加入
2 mol·L-1的NaOH溶液,生成沉淀的质量与加入NaOH溶液体积的关系如下图所示。试求:
(1)沉淀的最大质量。
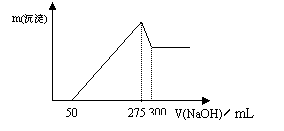 |
(2)原稀硝酸的物质的量浓度。