高三暑期素质教育培训测试化学试题2
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分150分。考试时间120分钟。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Mg-24 Al-27 Ca—40 Cu-64 I-127 Ba-137
第I卷(共64分)
注意事项:
1.答第I卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,答在试卷上无效。
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只是一个选项符合题意)
1.江苏是一个科技大省,拥有“纳米材料国家重点实验室”。我国科学家成功研制出了3mm长的碳纳米管,长度居世界之首。这种碳纤维强度高、刚度大、密度小、熔点高、化学稳定性好,因而被称为“超级纤维”。下列对此碳纳米管的说法中不正确的是
A.它是制造飞机的理想材料 B.它与石墨互为同素异形体
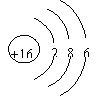 C.这种碳纳米管中含有非极性共价键
D.碳纤维复合材料为高分子化合物
C.这种碳纳米管中含有非极性共价键
D.碳纤维复合材料为高分子化合物
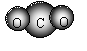 2.下列各项表达正确的是
2.下列各项表达正确的是
A.CO2的分子模型示意图: B.S2-的结构示意图:
C.乙烯分子的结构简式:CH2CH2 D.NH4Cl的电子式:
3.氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l); △H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g); △H=-283.0kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l); △H=-890.3kJ/mol
 相同质量的①氢气、②一氧化碳、③甲烷完全燃烧时,放出热量由多到少的顺序是
相同质量的①氢气、②一氧化碳、③甲烷完全燃烧时,放出热量由多到少的顺序是
A.①②③ B.②①③
C.②③① D.①③②
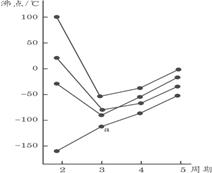
4.右图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
A.H2S B.HCl
C.PH3 D.SiH4
5.下列现象或应用中,不能用胶体知识解释的是
A.向鸡蛋白水溶液中加入一定量食盐会有物质析出
B.用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
C.在饱和FeCl3溶液中逐滴加入NaOH溶液,产生红褐色沉淀
D.将明矾加入混浊的水中,可以使水变澄清
6.1919年,Langmuir提出等电子体的概念:原子数相同、电子总数相同的分子,互称为等电子体;此后,等电子原理又有所发展,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体。等电子体的结构相似、物理性质相近。根据上述原理,下列各对粒子中,空间结构不相似的是
A.CO2与N2O B.CS2与NO2 C.CH4与NH4+ D.PBr3与NF3
7.设NA为阿佛加德罗常数,下列说法正确的是
A.标准状况下的11.2 L辛烷完全燃烧,生成二氧化碳分子数为4 NA
B.Na2O2与H2O反应生成1.12L O2(标准状况),反应中转移的电子数为2NA
C.46 g 二氧化氮和四氧化二氮组成的混合气体中含有的氧原子数为2 NA
D.质量为6g的石墨晶体中C-C键的数目为2NA
8.一定温度下,向质量分数为 a的乙腈(CH3CN)溶液中加入等体积水,所得溶液中乙腈质量分数为 0.4a ,现将25%乙腈和5%乙腈两溶液等体积混合,所得乙腈溶液的质量分数是
A.等于15% B.大于15% C.小于15% D.无法估算
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.科学家在高压下成功地将CO2转化为具有类似SiO2结构的晶体,下列关于CO2的原子晶体的说法正确的是
A.CO2的分子晶体转化为原子晶体是化学变化
B.CO2的原子晶体和分子晶体实际上是同种物质
C.CO2的原子晶体和分子晶体具有相同的物理性质
D.在CO2的原子晶体中,每一个C原子周围结合4个O原子
10.下列说法中正确的是
A.1 mol强酸与1mol强碱发生中和反应所放出的热量叫做中和热
B.用渗析法可除去鸡蛋白溶液中少量的氯化钠杂质
C.铝粉与氧化铁粉末反应中生成物总能量高于反应物总能量
D.H2S的热稳定性小于H2O是由于H2S分子间不存在氢键
11.关于某无色溶液中所含离子的鉴别,下列判断中正确的是
A.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42—存在
B.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I—存在
C.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl—存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中不一定有CO32—
12.某同学通过复习,做出的下列归纳正确的是
A.凡是有单质参加的反应一定是置换反应
B.凡是酸性氧化物都可直接与水反应生成对应的酸
C.凡是含金属元素的离子不一定都是阳离子
D.凡是由非金属元素组成的化合物一定是共价化合物
13.能正确表示下列化学反应的离子方程式是
A.碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2
B.用碳酸钠溶液吸收二氧化碳:![]() +CO2+H2O=2
+CO2+H2O=2![]()
C.氯气与烧碱溶液反应:Cl2+2OH—==Cl—+ClO—+H2O
D.FeS固体放人稀硝酸溶液中:FeS+2H+=Fe2++H2S↑
14.下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—
B.在强碱溶液中:Na+、K+、MnO4—、NO3—
C.在由水电离出的c(H+) =10—13mol/L 的溶液中:NH4+、Al3+、SO42—、NO3—
D.在无色透明溶液中:K+、AlO2—、Cl—、HCO3—
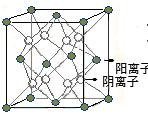 15.如图为CaF2晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是
15.如图为CaF2晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是
A.每个晶胞含有4个Ca2+和8个F-
B.晶体中与阳离子等距离且最近的阴离子个数为4
C.该晶体中的阴阳离子最外层均达8电子结构
D.该晶体中阳离子半径小于阴离子半径
16.下表中的陈述I、Ⅱ均正确性,且具有因果关系的是
| 选项 | 陈 述 I | 陈 述 Ⅱ |
| A | K元素的金属性比Na强 | K的密度比Na大 |
| B | 在空气中Al比Fe更耐腐蚀 | Fe比Al更容易失电子 |
| C | NaCl晶体中没有自由移动的离子 | NaCl晶体不导电 |
| D | FeCl3溶液能与Cu单质反应 | 用FeCl3溶液腐蚀制印刷电路板 |
第Ⅱ卷(非选择题 共86分)
三、(本题包括2小题,共22分)
17.(8分)亚硫酸根离子和二氧化硫中硫元素都是+4价。为了说明亚硫酸根离子既有氧化性又有还原性,请从提供的试剂中选择必要的药品,进行最简捷而现象鲜明的实验。
提供试剂:A.Na2SO3溶液 B.Na2S溶液 C.稀硫酸 D.NaOH溶液 E.溴水
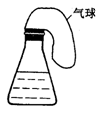 (注:以下选择的试剂,可以是2种或2种以上,但要符合题意)
(注:以下选择的试剂,可以是2种或2种以上,但要符合题意)
⑴要证明![]() 的化合物具有还原性,选择的试剂______________(填序号)。
的化合物具有还原性,选择的试剂______________(填序号)。
⑵若要用右图装置证明![]() 的化合物具有氧化性,选择的试剂是
的化合物具有氧化性,选择的试剂是
________________ (填序号),锥形瓶溶液中观察到的现象是_____________。
若气球保持常态,反应的离子方程式是_________________________________。
18.(14分) 某校开展从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质课外研究性学习活动,整个过程如下:
⑴干电池工作时正板上的反应是NH4++e—=NH3+![]() H2,该电极反应属于
反应(选填“氧化”或“还原”),MnO2的作用是除去正极上的产物,本身生成Mn2O3,该反应的化学方程式是
。
H2,该电极反应属于
反应(选填“氧化”或“还原”),MnO2的作用是除去正极上的产物,本身生成Mn2O3,该反应的化学方程式是
。
⑵锌皮和碳棒的回收:用钳子和剪子剪开回收的干电池的锌筒,将锌皮和碳棒取出,刷洗干净,将电池内的黑色粉末移入小烧杯中。
⑶氯化铵、氯化锌的提取、检验
①向小烧杯中加入一定量的热蒸馏水,充分搅拌, ,所得晶体即为ZnCl2、NH4Cl。
②设计简单的实验证明所得晶体中含有NH4+和Zn2+,并填写下列实验报告。
| 实验步骤 | 实验现象 | 实验结论 | 有关离子方程式 |
| 第一步:取少量晶体溶于蒸馏水配成溶液 |
|
| |
| 第二步: | 说明有NH4+ | ||
| 第三步:取少许溶液,加适量氨水,将悬浊液分成两份,一份加稀HCl,一份加足量NaOH溶液。 | 先生成白色沉淀,后沉淀都溶解 | 说明有Zn2+ |
|
有同学提出第三步Zn2+的检验所得结论不可靠,其原因是
。
四、(本题包括2小题,共16分)
19.(10分)⑴配平以下氧化还原反应方程式:
![]()
![]() 当KMnO4消耗0.05 mol时,得到的氧化产物的物质的量为__________,转移电子的数目为_______________。
当KMnO4消耗0.05 mol时,得到的氧化产物的物质的量为__________,转移电子的数目为_______________。
⑵家用液化气中主要成份之一是丁烷,当10 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量5×105 kJ,试写出丁烷燃烧反应的热化学方程式:
。
已知1 mol液态水气化时需要吸收44 kJ热量,则0.5 mol丁烷完全燃烧产生气态水时放出的热为 kJ。
20.(6分)在很长的一个历史时期,人们一直认为氟的含氧酸不存在。1971年美国科学家用F2通过细冰,获得次氟酸(HFO),对次氟酸的研究引起充分重视。
请回答:
⑴次氟酸的电子式为 ,次氟酸中F的化合价为________。
⑵次氟酸能与水反应得到溶液A,A中含有B、C二种溶质。B是一种非常稳定的化合物,C在MnO2催化作用下能迅速分解生成可使带火星的木条复燃的气体。次氟酸与水反应的化学方程式为 。
五、(本题包括2小题,共18分)
21.(8分)X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族,其中只有X和Y为金属,X原子的最外层电子数与次外层电子数相等,X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与NaOH溶液反应。
请回答下列问题:
⑴Y、Z、W形成的单核离子半径由小到大的顺序是______________。(用微粒符号回答)
⑵ZW2的结构式是______________,已知它在常温下呈液态,你认为ZW2形成晶体时,属于_________晶体。
⑶X与Y化学性质相似,则X与NaOH溶液反应的化学方程式是:
___________________________________________________________。
⑷0.1 mol的单质W与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是_________________。
22.(10分)以下是周期表中短周期元素的电负性数据。
| 0.98 | 1.57 | a 2.04 | b 2.55 | c | d 3.44 | e 3.98 | ||||||||
| f 0.93 | g 1.48 | h 1.61 | 1.90 | 2.19 | i 2.58 | j 3.16 |
⑴电负性越大,表示该元素原子越 (填“难”或“易”)形成阴离子。
⑵一般来讲,两元素的电负性差值大于1.7时,形成离子键;小于1.7时,形成共价键,则h、d组成的化合物属 化合物。
⑶b和i以原子个数比为1:2形成的化合物为A,A是________(填“极性分子”或“非极性分子”)。
⑷a~j中两种元素组成的化合物或单质,在某隔热的密闭容器中反应示意图如下。I表示反应前的分子状况,Ⅱ表示容器温度不再升高的分子状态,●和○分别表示不同的原子。
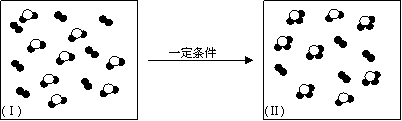 |
该反应的化学方程式为(不必注明反应条件) 。
 ⑸2001年3月发现a和g形成的化合物在39 K时呈超导性,可能是人类对超导认识的新里程碑。在该晶体的理想模型中,a原子和g原子是分层排布的,一层a一层g的相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是g原子投影,黑球是a原子投影,图中的a原子和g原子投影在同一平面上。根据右图确定该化合物的化学式为_____________。
⑸2001年3月发现a和g形成的化合物在39 K时呈超导性,可能是人类对超导认识的新里程碑。在该晶体的理想模型中,a原子和g原子是分层排布的,一层a一层g的相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是g原子投影,黑球是a原子投影,图中的a原子和g原子投影在同一平面上。根据右图确定该化合物的化学式为_____________。
六、(本题包括1小题,共14分)
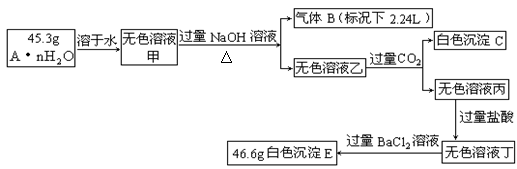 23.(14分)复盐A·nH2O中含有两种阳离子和一种阴离子,且知有下列变化关系:
23.(14分)复盐A·nH2O中含有两种阳离子和一种阴离子,且知有下列变化关系:
请回答下列问题:
⑴A·nH2O中含有三种离子是_____________、_____________、____________,A·nH2O的化学式____________________。
⑵白色沉淀C既可以看成是三元弱碱,也可以看成是一元弱酸。写出无色溶液乙与过量的CO2反应生成白色沉淀C的离子方程式:
_____________________________________________________________。
⑶在溶液丁中加入过量的BaCl2溶液后,在称量所的沉淀质量前需要进行的操作依次是___________________________________________,如何判断BaCl2溶液已经过量______________________________________________________________________。
七、(本题包括2小题,共16分)
24.(8分) 过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某过氧化物样品的组成,进行了如下实验。
①称取0.270g样品,灼热使之完全分解,生成CaO、O2和H2O,得到的O2在标准状况下的体积为33.6mL。
②另取0.120g样品,溶于稀盐酸,加热煮沸使生成的H2O2完全分解。然后将溶液中的Ca2+完全转化成CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.0200mol/LKMnO4溶液滴定,共用去31.0mLKMnO4溶液(已知:CaC2O4的氧化产物CO2,KMnO4的还原产物为MnSO4)。
(1)计算样品中的CaO2的质量分数。
(2)计算0.270g样品中的CaO质量。
25.(8分) 在室温下,向200 mL Cu(IO3)2饱和溶液(密度为1.0 g/cm3)中加入足量的经盐酸酸化的KI溶液,发生如下的反应:
2Cu(IO3)2+24KI+24HCl=2CuI+13I2+12H2O+24KCl
反应后,用0.22 mol/L Na2S2O3溶液滴定(I2 + 2S2O32- = 2I- + S4O62-),消耗了35.30 mL Na2S2O3溶液。计算:
⑴原饱和溶液中Cu(IO3)2的物质的量浓度。
⑵室温下Cu(IO3)2的溶解度。
暑期调研考试
高三化学试题2参考答案
一、单项选择题(本题包括8小题,每小题4分,共32分。)
1.D 2.A 3.D 4.D 5.C 6.B 7.C 8.C
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.AD 10.B 11.BD 12.C 13.BC 14.B 15.AC 16.CD
三.(本题包括2小题,共22分)
17.(1)A、E (2)A、B、C 有淡黄色沉淀生成 2S2-+SO32-+6H+=3S↓+3H2O
(每空2分,共8分)
18.(1)还原 2MnO2+H2===Mn2O3+H2O
(3)①趁热过滤,将滤液冷却(再过滤)
②第二步:取少许溶液,加NaOH加热,在试管口附近放湿润红色石蕊试纸 试纸变蓝 NH4++OH—==NH3↑+H2O
Al(OH)3也具有两性,无法判断原溶液中是Zn2+还是Al3+
(每空2分,共14分)
四.(本题包括2小题,共16分)
19.(1)5 2 3 10 1 2 8H2O 0.25mol 0.25NA
(2)C4H10(g)+13/2O2(g)→4CO2(g)+5H2O(l); △H= —2900kJ/mol
(3)1340kJ (每空2分,共14分)
20.(1)![]() -1 (2)HFO+H2O=HF+H2O2(每空2分,共6分)
-1 (2)HFO+H2O=HF+H2O2(每空2分,共6分)
五.(本题包括2小题,共18分)
21.(1)Al3+<Cl-<S2- (2) Cl-S-Cl 分子 (3)Be+2NaOH=Na2BeO2+H2↑ (4)3:5
![]() (每小题2分,共8分)
(每小题2分,共8分)
22.(1)易 (2)离子 (3)非极性 (4)2SO2+O2 2SO3 (5)MgB2
(每空2分,共10分)
六.(本题包括1小题,共14分)
23.(1)NH4+、Al3+、SO42- NH4Al(SO4)2·12H2O
(2)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)过滤、洗涤、干燥 静置后,向上层清液中继续加入BaCl2溶液,若无沉淀生成则说明BaCl2溶液已过量
(每空2分,共14分)
七.(本题包括2小题,共16分)
24.(1)w(CaO2)=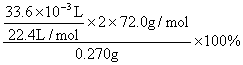 =80%……………………(2分)
=80%……………………(2分)
(2)根据电子守恒可确定CaC2O4与KMnO4的物质的量之比为![]() ………………(2分)
………………(2分)
n(CaC2O4)=n(Ca2+)=31.0×10-3L×0.0200mol/L×![]() =0.00155mol…………………(2分)
=0.00155mol…………………(2分)
其中CaO2所含的n(Ca2+)=![]() =0.00133mol
=0.00133mol
m(CaO)=(0.00155mol-0.00133mol)×56.0g/mol=0.0123g…………………………(2分)
25.⑴2Cu(IO3)2 ~ 13I2 ~ 26Na2S2O3 …………………………………………(2分)
2mmol 26mmol
(0.60mmol) 0.22×35.30m mol……………………………………(2分)
c[Cu(IO3)2]=![]() =3.0×10-3 mol/L…………………………………………(2分)
=3.0×10-3 mol/L…………………………………………(2分)
⑵m[Cu(IO3)2]=0.00060mol×414g/mol=0.248g
又200 mL Cu(IO3)2饱和溶液的质量为200g
故室温下Cu(IO3)2的溶解度为0.124g……………………………………………(2分)
注:第二卷其他合理答案参照给分。