高三化学:化学证明题
化学证明题是化学学习中不多见的一类习题。由于陌生度高,因而有难度。
●难点磁场
请试做下列题目,然后自我界定学习本篇是否需要。
试设计简单实验证明:在醋酸溶液中存在着下列平衡:
CH3COOH![]() CH3COO-+H+
CH3COO-+H+
答:_____________________________________________________________________。
●案例探究
[例题]已知CsCl结构如图47—1所示:
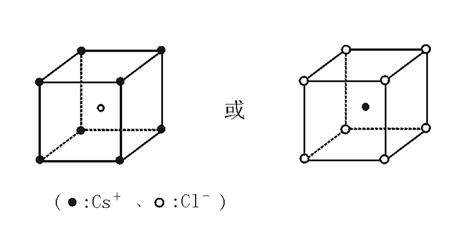
图47—1
试证明AB型离子晶体中,r(阳离子)∶r(阴离子)≥0.732时,其晶体结构与CsCl晶体结构相同。
命题意图:考查学生对CsCl晶体结构的认识及应用数学方法解决化学问题的能力。
知识依托:CsCl的晶体结构及相关几何知识。
错解分析:不能抽象出图形与r+(阳离子半径)、r-(阴离子半径)的关系而无解。
解题思路:CsCl晶体结构如图47—2所示,按图取一个截面,可予以证明。
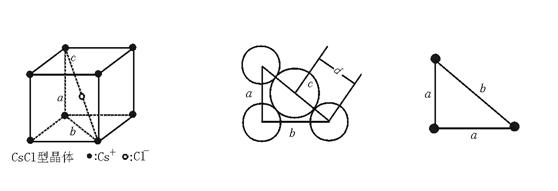 图47—2
图47—2
设立方体棱长为a,阴、阳离子核间距离为d,立方体一个面的对角线长为b,立方体对角线长为c。则:d=r++r-;则a≥2r-
因为:c2=a2+b2,b2=a2+a2
所以:c2=3a2,c=![]() a
a
又因为:c=2d,且a≥2r-
所以:2d≥![]() ·2r-,即
·2r-,即
d=r++r-≥![]() r-,r+≥(-1+
r-,r+≥(-1+![]() )r-,
)r-,
![]() ≥
≥![]() -1=1.732-1=0.732
-1=1.732-1=0.732
证明完毕。
●锦囊妙计
常见化学证明题有两种:
1.实验证明题:根据实验现象判断某些物质存在与否、验证某些结论正确与否。要注意化学试剂的选择。
2.几何证明题:利用数学工具推证某些结论正确与否。要注意图形的转换,以及化学习题与数学方法的联系。
●歼灭难点训练
1.(★★★)用实验证明某酸HA是弱电解质。两同学的方案分别是:
甲:①称取一定量的HA配制0.1 mol·L-1的溶液100 mL。
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填“>”“<”“=”)
乙方案中,说明HA是弱电解质的现象是________(多选扣分)。
a.装HCl(aq)的试管中放出H2的速率快;
b.装HA(aq)的试管中放出H2的速率快;
c.两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处 、 。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要的表述________。
2.(★★★★)Cu+在酸性溶液中不稳定,可发生自身氧化——还原反应生成Cu2+和Cu。现有浓H2SO4、浓HNO3、稀H2SO4、稀HNO3、FeCl3(aq)、pH试纸,而没有其他试剂。请用最简便的实验方法来证明CuO经H2还原所得到的红色产物中是否含有碱性氧化物Cu2O。
3.(★★★★)证明AB型离子晶体中,![]() ≥0.414时,其晶体结构与NaCl晶体结构相同。
≥0.414时,其晶体结构与NaCl晶体结构相同。
4.(★★★★★)一般认为红热木炭与浓H2SO4发生反应的化学方程式为: ,试设计实验证明产物中是否含有CO。
(1)实验装置为(可用简笔画表示,但要注明仪器及药品名称,夹持装置可忽略) ;
(2)产物中含有CO的现象是 。
附:参考答案
难点磁场
1.提示:须证明两个问题:①溶液中存在着H+(或Ac-);②c(H+)发生变化,即平衡发生移动。
答案:往醋酸溶液中滴加石蕊试剂,溶液变红,证明醋酸在水溶液中能电离出H+
在上述的溶液中再加入少量CH3COONH4晶体,振荡后红色逐渐变浅,说明c(H+)减小,即证明存在着电离平衡:CH3COOH ![]() CH3COO-+H+。
CH3COO-+H+。
歼灭难点训练
1.提示:只知弱酸的物质的量浓度,不知其电离度,难以配制pH=1的该酸溶液。
答案:(1)100 mL容量瓶
(2)> b
(3)配制pH=1的HA(aq)难以实现,不妥之处在于加入的锌粒难以做到表面积相同
(4)配制NaA(aq),测其pH>7即证明HA是弱电解质(注:本题解答若操作简单、现象明显、不是化学教材中讲过的常见方法应属创新,经认可后亦可)
2.提示:选用FeCl3(aq)、稀HNO3、浓HNO3、浓H2SO4都是错误的。认为能观察到无色固体生成或红色固体溶解也都是错误的。
答案:取少量红色产物放入稀H2SO4中,振荡,若溶液变为蓝色,说明溶液中含有Cu2O,若溶液不变色,说明产物中无Cu2O。
3.NaCl晶体结构如图所示,取其一个截面(或侧面)进行推理,可予以证明。
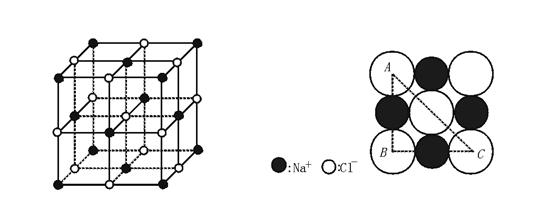
令r-=1,则AC≥4r-=4,AB=BC=2r-+2r+=2+2r+
因为:△ABC为Rt△
![]()
![]()
![]() 所以:AB2+BC2=AC2
所以:AB2+BC2=AC2
即:(2+2r+)2+(2+2r+)2≥42,r+≥![]() -1=0.414
-1=0.414
故:![]() ≥0.414
≥0.414
证明完毕。
4. C+2H2SO4![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(1)
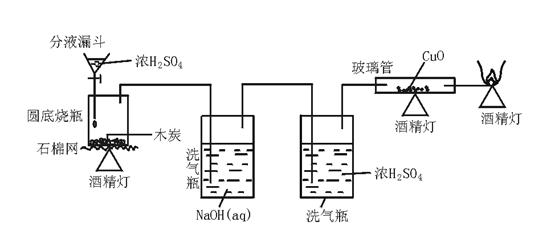
(2)黑色CuO粉末变红证明有CO生成(注:答“导管末端有火焰证明有CO生成”不可以)