高三化学综合练习(六)
第Ⅰ卷(共74分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg24 Al 27 S 32
C1 35.5 Mn 55 Fe 56 Zn 65 Ag 108 Ba 137
第Ⅰ卷(选择题 共74分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.下列关于某些社会热点问题的说法中,不正确的是
A.禁止使用含铅汽油是为了提高汽油的燃烧效率
B.三峡工程的建成使用有助于控制温室效应和酸雨的产生
C.甲醛是某些劣质装饰板材释放的常见污染物之一
D.开发生产无汞电池,可大幅度降低电池对土壤、水源的污染
2.下列物质中,长久露置于空气中会发生颜色变化的是
①绿矾 ②氢氧化亚铁 ③氯水 ④石炭酸 ⑤亚硫酸钠 ⑥过氧化钠
A.全部 B.①②③④⑥ C.只有①②③ D.只有②③④
3.同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,下列说法正确的是
A.所含分子数和质量均不相同 B.含有相同的分子数和电子数
C.含有相同的质子数和中子数 D.含有相同数目的中子、原子和分子
4.下列说法中正确的是
A.凡含有阳离子的晶体必定含有阴离子
B.离子晶体中可能含有共价键
C.冰、液态水和水蒸气中都存在氢键
D.N≡C—C≡N分子中碳—氮间的核距离大于碳—碳间的核距离
5.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子均满足最外层8电子稳定结构,结合周期表知识,有关说法正确的是
A.羰基硫的电子式为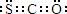
B.羰基硫属于非极性分子
C.羰基硫沸点比CO2低
D.羰基硫分子中三个原子不可能处于同一直线
6.进行化学实验时必须要有安全意识。下列做法错误的是
A.被玻璃割伤手后,先取出伤口里的碎玻璃片,再用稀双氧水擦洗,然后敷药包扎
B.苯酚沾在皮肤上应立即用酒精擦洗
C.温度计摔坏导致水银散落到地面上,应立即用水冲洗水银
D.酒精灯碰倒洒出酒精着火,迅速用湿抹布扑盖
7.下列说法或表示方法正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石,s)=C(石墨,s);△H=-1.90 kJ/mol可知,金刚石比石墨稳定
C.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=+285.8 kJ/mol
D.在稀溶液中H+(ag)+OH-(ag)=H2O(l);△H=-57.3 kJ/mol若将含0.5 mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ
8.100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)
![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①烧瓶内气体的颜色不再加深,②N2O4 的消耗速率与NO2的生成速率之比为1∶2,③NO2的生成速率与NO2消耗速率相等,④NO2的物质的量浓度不变,⑤烧瓶内气体的质量不再变化,⑥烧瓶内气体的压强不再变化,⑦烧瓶内气体的密度不再变化,⑧烧瓶内气体的平均相对分子质量不再变化
A.②⑤⑦ B.①③④⑥⑧ C.只有③ D.只有⑤
二、选择题(本题包括10小题,第9~16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
|
|
|
![]()
|
|
![]() D.乙酸乙酯与乙酸的混合物
弃去上层,除去杂质乙酸
D.乙酸乙酯与乙酸的混合物
弃去上层,除去杂质乙酸
10.设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5 NA
B.1 mol Na2O2与足量的水反应,转移的电子数为2NA
![]() C.NA 个SO3分子在标准状况下的体积为22.4 L
C.NA 个SO3分子在标准状况下的体积为22.4 L
D.常温常压下,62g白磷分子( )中的共价键数为3NA
11.能正确表示下列反应的离子方程式是
A.FeO溶于足量稀HNO3:FeO+2H+=Fe2++H2O
B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.向澄清石灰水中通入少量CO2:Ca2++2OH-+CO2=CaCO3↓+H2O
D.将0.2mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
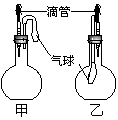 12.如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都有明显地胀大(忽略液体体积对气球的影响)。则所用试剂分别可能依次是
12.如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都有明显地胀大(忽略液体体积对气球的影响)。则所用试剂分别可能依次是
A.甲:浓硫酸和木炭 乙:浓氨水和SO2
B.甲:双氧水和MnO2 乙:NaOH溶液和CO2
C.甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2
D.甲:浓硫酸和蔗糖(滴有几滴水) 乙:水和氨气
 13.将Mg条、Al条平行插入一定浓度的NaOH溶液中,用导线、用电器连接成原电池,此电池工作时,下列叙述中正确的是
13.将Mg条、Al条平行插入一定浓度的NaOH溶液中,用导线、用电器连接成原电池,此电池工作时,下列叙述中正确的是
A.Mg比Al活泼,Mg 失去电子被氧化成Mg2+
B.负极反应式为:Al-3e-+4OH-=AlO2-+2H2O
C.该电池的内外电路中,电流均是由电子定向移动形成的
D.Al是电池阴极,开始工作时溶液中会立即有白色沉淀析出
14.pH=2的两种一元酸HX和HY的溶液分别取50mL,加入过量的镁粉,充分反应后,收集H2的体积在相同状况下分别为V1和V2,若V1>V2,下列说法正确的是
A.HX一定是弱酸
B.NaX水溶液的碱性弱于NaY水溶液的碱性
C.HX一定是强酸
D.反应开始时二者生成H2的速率相同
15.下列各选项所述的两个量,前者一定大于后者的是
①HF和HBr的沸点,②纯水在25℃和80℃时的pH,③同温下分别在100g水中最多能溶解的无水CuSO5和CuSO5·5H2O的质量,④25℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水的分子数,⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数,⑥耐火材料MgO和CaO的熔点,⑦H-和H+离子半径,⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
A、①②⑥ B、①②③⑤ C、⑤⑥⑦ D、①②⑥⑦
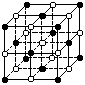 16.KO2的晶体结构与NaCl相似,可以看作是Na+的位置用K+代替,Cl -的位置用O2 - 代替,下列对KO2晶体结构的描述正确的是
16.KO2的晶体结构与NaCl相似,可以看作是Na+的位置用K+代替,Cl -的位置用O2 - 代替,下列对KO2晶体结构的描述正确的是
A.和K+距离相同且最近的O2 -共有8个
B.和K+距离相同且最近的K+共有12个
C.和K+距离相同且最近的O2 –构成的多面体是正八面体
D.和K+距离相同且最近的O2 –构成的多面体是正六面体
17.T℃时,在容积恒定的密闭容器中A气体与B气体反应生成C气体,反应过程中A、B、C浓度的变化如下图a所示,若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如下图b所示,则下列结论正确的是
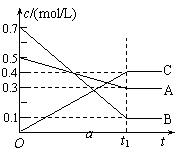 | 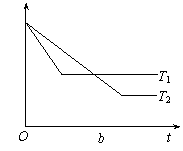 | ||
A.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
B.T℃时,若在该容器中由0.4mol/LA、0.4mol/LB和0.2mol/LC反应,达到平衡后,C的浓度仍为0.4mol/L
C.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
D.(t1+10)min时,保持压强不变,通入稀有气体,平衡向正反应方向移动
18.用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200 mL 0.3 mol/L NaCl的溶液和300 mL 0.2 mol/L的AgNO3溶液,当产生0.56L(标准状况)Cl2时停止电解,取出电极,将两烧杯溶液混合,混合液的pH为(假设:电解过程中电解产物不发生其它变化,混合后溶液的总体积为500mL)
A.1.4 B.5.6 C.7 D.12.6
第Ⅰ卷:选择题 班级: 姓名:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共20分)
19.(10分)请按要求填空
(1)下列实验操作或对实验事实的叙述正确的是 (填序号)。
①用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加到浓硝酸中,并不断搅拌;
③配置100mL1.00mol/L的NaCl溶液时,可用托盘天平称取5.85g NaCl固体;
 ④向可能含有SO42-、SO32-的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验SO42-的存在;
④向可能含有SO42-、SO32-的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验SO42-的存在;
⑤蒸发NaCl溶液以得到NaCl固体时,不必将溶液蒸干;
⑥向100℃时的NaOH稀溶液中滴加饱和的FeCl3溶液,以制备
Fe(OH)3胶体;
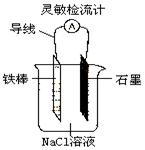
⑦如右图,可观察到灵敏检流计的指针偏转;
⑧向AlCl3溶液中滴加NaOH溶液和向NaOH溶液中滴加AlCl3溶液的现象相同。
(2)现有0.1mol·L-1的纯碱溶液,用pH试纸测定该溶液的pH,其正确的操作是 。你认为该溶液pH的范围一定介于 之间。请你设计一个简单的实验方案证明纯碱溶液呈碱性是由CO32-引起的:______________________________________________
_______________________________________________________________________________。
![]()
![]()
![]()
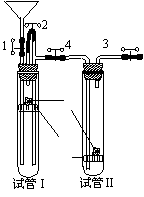 20.(12分)某教师用如下图所示装置做“稀硝酸的氧化性及NO的性质等”演示实验。图中1、2、3、4为止水夹。操作步骤如下:
20.(12分)某教师用如下图所示装置做“稀硝酸的氧化性及NO的性质等”演示实验。图中1、2、3、4为止水夹。操作步骤如下:
①检查装置的气密性;
②打开1、2、3、4,经漏斗加入稀硝酸,直至酸液充满试管I;
③关闭1、2,打开3、4,用酒精灯微热试管I,当铜丝表面有
气泡产生时,立即撤去酒精灯;
④随着反应进行,I中液体会流入II并浸没隔板上的铜丝,此
时立即加热试管II,即可看到II中有红棕色气体产生。当红
棕色气体充满II后,立即关闭3;
⑤一段时间后,关闭4并撤去酒精灯,将试管II(连同塞子及止
水夹3、4)浸入盛有冰水的大烧杯中。
试回答下列问题:
⑴检查装置气密性的方法及现象_____________________________________________
____________________________________________________________________。
⑵步骤②中稀硝酸要充满试管I的_________________________________________。
⑶步骤③中发生反应的离子方程式为______________________________________。
⑷步骤④中产生红棕色气体的化学方程式是__________________________________。
该步骤中关闭3产生的结果是_____________________________________________。
⑸实验中观察到初始阶段步骤④中产生气体的速率明显快于步骤③,你认为其可能的原因是___________________________________________________________。(写出一条即可)
⑹步骤⑤中可观察到的主要现象是_________________________________________。
四、(本题包括2小题,共20分)
21.(11分)已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
①A+B![]() M+D+E;②M+E→A+F+B。请针对以下两种不同情况回答:
M+D+E;②M+E→A+F+B。请针对以下两种不同情况回答:
⑴若A是一种钠盐,反应①是化学工业上制取单质E和化合物M的重要方法。则A的电子式为_________________;反应②的离子方程式为_____________________________;
在酸性条件下,若将化合物F加到含Fe2+的溶液中,溶液从浅绿色变成黄色,该反应的离子方程式为____________________________________________________。
⑵若A是一种含氧酸盐,可用于实验室中检验水的存在。1个A的酸根离子中共含有50个电子,其中含有一种元素X,X的原子最外层电子数是电子层的2倍,则X在元素周期表中的位置是第________周期_______族。X单质的熔点是112.8℃,则X单质的晶体类型属于__________晶体。X与碳单质在一定条件下可以生成CX2的化合物,其分子结构类似于CO2,则CX2属于(填“极性”或“非极性”)_____________分子。反应②的化学方程式为_______________________________________________________。
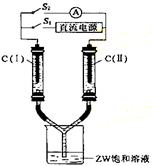 (3)如右图所示装置,两玻璃管中盛满滴有酚酞溶液的
(3)如右图所示装置,两玻璃管中盛满滴有酚酞溶液的
ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接
通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。
一段时间后(两玻璃管中液面未脱离电极),断开S1,
接通S2,电流表的指针发生偏转。此时:C(Ⅰ)的电极
名称是: ,
(填写“正极”、“负极”、“阴极”、“阳极”);
C(Ⅱ)的电极反应式是: 。
22.(9分)⑴常温下将0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+);
(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)= mol/L;c(H+)-c(MOH)= mol/L。
⑵常温下若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
⑶常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH_________。(填“>7”、“<7”、或“无法确定”)
五、(本题包括两小题,共20分)
23.(8分)在一定温度下,向一个容积不变的容器中,加入3molSO2和2molO2 及固体催化剂,使之反应。2SO2(g) + O2 (g) ![]() 2SO3 (g) ;△H=-196.6kJ/mol。平衡时容器内气体压强为起始时的90%。此时
2SO3 (g) ;△H=-196.6kJ/mol。平衡时容器内气体压强为起始时的90%。此时
(1)加入3molSO2和2molO2 发生反应,达到平衡时,放出的热量为 。
(2)保持温度不变,在相同的容器中,将起始物质的量改为amolSO2、bmolO2、cmolSO3(g)(C>0),欲使平衡时SO3的体积分数为2/9 ,O2的体积分数为1/3,
①达到平衡时,Ⅰ与Ⅱ放出的热量 (填序号)。
A. 相等 B. 前者小于后者 C. 前者大于后者 D无法确定
②a、b、c必须满足的关系是 、 。
(一个用a、c表示,另一个用b、c表示)
③欲使起始时反应表现为向正反应方向进行,a的取值范围是: 。
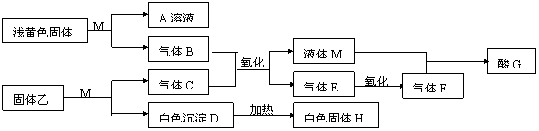 24.(14分)M为一种常见的液体试剂。下列物质在一定条件下可发生如下图所示的转化关系。
24.(14分)M为一种常见的液体试剂。下列物质在一定条件下可发生如下图所示的转化关系。
试填写题中空白:
(1) 若固体乙是硫化铝,试回答:
①C、E、F化学式C 、E 、F
②E→F的化学方程式
③D溶解于A溶液的离子方程式
(2)若白色沉淀D不能溶解于A溶液,气体C能使湿润的红色石蕊试纸变蓝,回答:
④固体乙可能
⑤B+C→M+E的化学方程式
六、(本题包括两小题,共16分)
25. (8分)据材料称:钠可在氮气中燃烧生成氮化钠,氮化钠与水反应的化学方程式是:Na3N+4H2O==3NaOH+NH3·H2O。某学校化学研究学习小组,为了研究钠在空气中燃烧产物的成分,做了以下实验:取11.5g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧产物投入水中,得到一种纯净气体0.224L(标准状况)和1000mL溶液,从中取出25.00mL溶液,与13.50mL 1.00mol·L-1HCl溶液刚好完全反应。求钠在空气中燃烧产物的成分及物质的量。
(8分)据材料称:钠可在氮气中燃烧生成氮化钠,氮化钠与水反应的化学方程式是:Na3N+4H2O==3NaOH+NH3·H2O。某学校化学研究学习小组,为了研究钠在空气中燃烧产物的成分,做了以下实验:取11.5g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧产物投入水中,得到一种纯净气体0.224L(标准状况)和1000mL溶液,从中取出25.00mL溶液,与13.50mL 1.00mol·L-1HCl溶液刚好完全反应。求钠在空气中燃烧产物的成分及物质的量。
26.(9分)将等物质的量的两种中学化学常见的氧化物溶于100mL硫酸,而后逐滴加入1.00mol/L的NaOH溶液。当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH的加入量增加而逐渐增加。当NaOH的体积V2=650mL时,沉淀量达到最大值,继续滴加NaOH时,沉淀量逐渐减小。当V2≥750mL时,沉淀量不再改变。
⑴最初加入的50mLNaOH溶液的作用是__________________________________。
⑵计算所用的硫酸的物质的量浓度。
⑶试判断两种氧化物各是什么,并计算其物质的量。
化学综合练习(六)参考答案
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.A 2.B 3.D 4.B 5.A 6.C 7.D 8.A
二、选择题(本题包括10小题,第9~16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.B 10.AD 11.CD 12.BD 13.B 14.AD 15.D 16.BC
17.B 18.C
三、(本题包括2小题,共20分)
19.(1)②⑤⑦(共4分,选错1个倒扣1分,本题不出现负分)(2)①把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH ②7~13 ③向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液, 产生白色沉淀,且溶液的红色褪去。说明纯碱溶液呈碱性是由CO32-引起的。(每空2分)
20.⑴打开止水夹1、2、4,关闭3,在I中加入适量水,使与漏斗连接的导管内形成水柱后停止加水,若一段时间后,水柱不下降,则说明装置的气密性好。
⑵排尽试管I中的空气,防止产生的气体被氧化
⑶3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
⑷2NO+O2=2NO2 会使稀硝酸重新回流到试管I中,脱离铜丝
⑸可能是反应生成的Cu2+起催化作用;可能是溶液中溶解的少量NO起催化作用;溶液的温度比较高(只要言之有理、自圆其说即给1分)
试管内气体的红棕色变浅(前4小题每空2分,最后2小题每空1分,共12分)
![]() 四、(本题包括2小题,共20分)
四、(本题包括2小题,共20分)
![]() 21.⑴
Cl2+2OH-=Cl-+ClO-+H2O 2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
21.⑴
Cl2+2OH-=Cl-+ClO-+H2O 2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
⑵三 ⅥA 分子 非极性 Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
(每个方程式2分,其余各1分,共11分)
22.⑴①>(1分) ② 9.9×10-7(2分) 1.0×10-8(2分) ⑵<(2分) ⑶<7 (2分)
五、(本题包括两小题,共20分)
23.(1)98.3kJ (2分)(2)① C (2分) ② a+c =3 (1分) b+c/2=2(1分) ③2<a<3(2分) ⑶ 负极 (2分) Cl2 + 2e—== 2Cl— (2分)
24.(1) ① C: H2S、E: SO2、F: SO3(每空2分)② 2 SO2 + O2 ![]() 2SO3(2分,其中条件1分)③Al(OH)3+OH-
2SO3(2分,其中条件1分)③Al(OH)3+OH- AlO2-+2H2O(2分)
(2) ④Mg3N2 (2分) ⑤ 4NH3+5O2 4NO+6H2O (2分)
六、(本题包括两小题,共16分)
25.解: n(Na)=0.500 mol
钠在有限的空气中燃烧可能有Na2O、Na2O2、Na3N。
n(O2)=0.0100 mol
2Na2O2+2H2O==4NaOH+O2↑
0.0200 mol 0.0100 mol
Na→NaOH
c(NaOH)=0.500mo1·L-1,25 mL溶液中n(NaOH)=1.25×10—2mol
n(HCl)=1.35×10-2mol>n(NaOH),说明溶液中还有氨水。(2分)
原l L溶液中n(NH3·H2O)=40×0.100×10-2 mo1=4.00×10-2mol
Na3N+4H2O==3NaOH+NH3·H2O
4.00×10-2 mol 4.00×10-2mol
即:n(Na3N)=0.0400mo1(2分) n(Na2O2)=0.0200mol(2分)
n(Na2O)=(0.500 mo1一0.0400 mo1×3-0.020 mo1×2)/2=0.170 mo1(2分)
26.⑴中和过量的硫酸(2分)
⑵由电荷守恒知,沉淀量最大时,所用OH-的物质的量等于硫酸中的H+的物质的量。
n(OH-)= 1.00mol/L×0.650L=0.650mol,故c(H2SO4)=![]() =3.25mol/L(2分)
=3.25mol/L(2分)
⑶由题意可知,其中一种氧化物为Al2O3,由反应式Al(OH)3+OH-= AlO2-+2H2O,该反应用去的n(NaOH)= 1.00mol/L×(0.750L-0.650L)=0.100mol,故Al(OH)3为0.100mol,则Al2O3为0.0500mol。(2分)
由Al3++3OH-= Al(OH)3↓知,生成Al(OH)3用去0.300mol,则生成另一种氢氧化物用去的NaOH为0.600mol-0.300mol =0.300mol,且已知两种氧化物的物质的量相等,故另一种氧化物也是三价金属的氧化物,又是不溶于过量碱的常见氧化物,可知其为Fe2O3,其物质的量为0.0500mol。(3分)