高三化学综合练习(五)
第Ⅰ卷(共74分) 12月26日
可能用到的相对原子质量:H-1 Na-23 S-32 O-16 Cu-64 Fe-56 N-14 Na-23 I-127
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.下列各化学式既能表示物质的化学组成,又能表示物质分子式的是
①Mg ②NH4NO3 ③CH2O ④SiO2 ⑤C6H5NO2 ⑥Al2O3 ⑦NH3·H2O
⑧P ⑨Ag(NH3)2OH ⑩S8
A.①②⑤⑧ B.③⑤⑦⑩ C.③④⑦⑧ D.③⑤⑥⑨
2.高压电机、复印机工作时会产生臭氧,该气体有强氧化性。下列叙述中不正确的是
A.臭氧和氧气是氧的同素异形体 B.臭氧可使湿润的KI淀粉试纸变蓝
C.臭氧的存在对人体有益无害 D.臭氧是很好的消毒剂和脱色剂
3.将溶质的质量分数为a%、物质的量浓度为c1 mol/L的H2SO4溶液蒸发掉一定量的水,使其溶质的质量分数变为b%,此时物质的量浓度为2c1 mol/L,则a和b的关系是
A.a=2 b B.b=2a C.2a> b D.2a< b
4.共价键的断裂有均裂和异裂两种方式,即:均裂:A∶B → A·+B· ;异裂:A∶B → A++[∶B]-。下列化学反应中发生共价键均裂的是
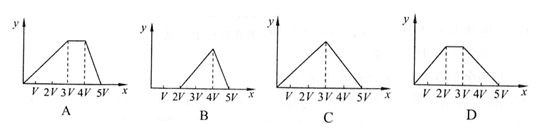
A.2K+2H2O=2KOH+H2↑
B.2Na+2C2H5OH → 2C2H5ONa+H2↑
C.Na2CO3+H2O![]() NaHCO3+NaOH
NaHCO3+NaOH
D.CH3COOH+C2H5OH ![]() H2O+CH3COOC2H5
H2O+CH3COOC2H5
5.2005年9月始,“禽流感”在全球部分地区爆发,引起了人们继“非典型性肺炎”之后的世界范围内的恐慌。做好环境消毒是预防“禽流感”的重要措施,常用的消毒剂是ClO2或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-。下列有关说法中正确的是
A.ClO2的分子结构呈V型,属非极性分子
B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位气体体积得电子的数目表示)是Cl2的5倍
C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害
D.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3 + 2NaClO3 + H2SO4 = 2Na2SO4 + 2ClO2↑+ H2O
6.下列实验操作中,错误的是
A.配制5%食盐溶液时,将称量的食盐放在烧杯中加适量的蒸馏水搅拌溶解
B.硫酸铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅
C.配制氯化铁溶液时,将一定量的氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
D.用pH试纸测得新制氯水的pH为2
7.等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、
VB、VC,已知VB=2VC,VA=VB+VC,则在C的生成物中,该金属元素的化合价为
A.+1 B.+2 C.+3 D.+4
8.2005年10月12日我国成功发射了第二艘载人航天飞船——“神州六号”,实现了双人多天太空旅行。这标志着中国人的太空时代又前进了一大步。发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol
C.N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l);△H = – 1135.7kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol
二、选择题(本题包括10小题,9-16题每小题4分,第17、18题每题5分,共42分。每小题有一个或两个答案符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个,该小题为0分)
9.下列有关物质的结构或性质的叙述错误的是
A.水是一种非常稳定的化合物,这是由于氢键所致
B.由极性键形成的分子不一定是极性分子
C.CH4、H2O、HF、NH3的沸点依次降低
D.分子晶体中一定存在分子间作用力,可能有共价键
10.下列离子方程式中正确的是
A.往硝酸银溶液中滴加少量氨水:Ag++2NH3==[Ag(NH3)2]+
B.相同物质的量浓度的FeI2溶液与Br2水溶液等体积混合
2Fe2++2I—+2Br2==2Fe3++I2+4Br—
C.四氧化三铁溶于氢碘酸溶液中 Fe3O4+8H++2I—==3Fe2++I2+4H2O
D.往大量的硫酸氢钾溶液中滴加少量氢氧化钡溶液
H++SO42—+Ba2++OH—==BaSO4 ↓+H2O
11.NA表示阿伏加德罗常数,下列说法中不正确的是
A.在1L 0.5 mol/L的Na2CO3溶液中,离子总数一定大于1.5 NA
B.在常温常压下,n mol HD含有的核外电子数为2n NA
C.12.5 mL 16 mol/L浓硫酸与足量铜反应,转移的电子数为0.2 NA
D.含有1 mol碳原子的金刚石中,C—C共价键数为4 NA
12.一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,电极反应式为:C2H6+18OH--14e-=2CO32-+12H2O;7H2O+7/2O2+14e-=14OH-。有关此电池的推断错误的是
A.通氧气的电极为负极
B.参加反应的O2与C2H6的物质的量之比为7∶2
C.电池工作一段时间后,KOH的物质的量浓度将下降
D.在电解质溶液中CO32-向正极移动
13.铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。Tl3+与Ag在酸性介质中发生反应:Tl3++ 2Ag ==Tl+ + 2Ag+。下列推断正确的是
A.Tl+ 的最外层有1个电子 B.Tl 3+的氧化性比Al3+的弱
C.Tl能形成+3价和+1的化合物 D.Tl+ 的还原性比Ag强
14.将物质的量相等的Al2(SO4)3和(NH4)2SO4溶于水,形成V L混合溶液,向该混合溶液中逐滴加入某NaOH溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列各图示中,能正确表示加入NaOH溶液的体积(x)与生成沉淀的物质的量(y)的关系的是
15.Va L pH=2的盐酸与Vb L pH=12的氨水混合,若所得溶液显酸性,下列有关判断正确的是
A.Va 一定等于 Vb
B.Va 一定大于 Vb
C.混合溶液中离子浓度一定满足: c(Cl-) > c(NH4+)> c(H+)> c(OH-)
D.混合溶液中离子浓度一定满足: c(NH4+) + c(H+) = c(Cl-)+ c(OH-)
![]() 16.在一定条件下,固定容积的密闭容器中反应:2NO2(g) O2(g)+ 2NO(g);ΔH>0, 达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
16.在一定条件下,固定容积的密闭容器中反应:2NO2(g) O2(g)+ 2NO(g);ΔH>0, 达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
A、当X表示反应时间时,Y表示混合气体的密度
B、当X表示压强时,Y表示NO2的转化率
C、当X表示温度时,Y表示NO2的物质的量
D、当X表示NO2的物质的量时,Y表示O2的物质的量
17.将2
mol X、3 mol Z两种气体混合于某体积不变的密闭容器内发生如下反应:2X(g )+Y(g) ![]() 3 Z(g)平衡时,生成n molZ。恒温恒压时,按下列配比投入各物质,达到平衡时,Z的物质的量大于n mol的是:
3 Z(g)平衡时,生成n molZ。恒温恒压时,按下列配比投入各物质,达到平衡时,Z的物质的量大于n mol的是:
A.3.2 mol X、0.6 mol Y、1.2 mol Z
B.3.6 mol X、1 mol Y、0.6 mol Z
C.2.8 mol X、0.4 mol Y、1 mol Z
D.2.2 mol X、0.2 mol Y、2.4 mol Z
18.有甲、乙两醋酸稀溶液,测得甲的pH=a,乙的pH=a+1。下列推断中正确的是:
A.物质的量浓度c(甲)=10c(乙)
B.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍
C.中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)> 10V(甲)
D.甲中的c(OH-)为乙中c(OH-)的10倍
第Ⅰ卷(选择题 共74分) 班级: 姓名:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
第Ⅱ卷(非选择题(共76分)
三、(本题包括2小题,共22分)
19.(10分)(1)下列是某学习小组的同学关于某无色溶液中所含离子鉴别的实验设计方案。请指出存在问题的实验方案,并说明理由(有几组写几组,不一定填满,多写倒扣分)。
A.加入KSCN溶液后溶液不显红色,再加几滴氯水溶液颜色变为红色。说明原溶液中含Fe2+
B.加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液由无色变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸后,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有CO32-
E.加入浓NaOH溶液并加热产生使湿润红色石蕊试纸变蓝的气体,说明溶液中含NH4+
① 。
② 。
③ 。
(2)实验室配制95mL0.100mol/LCuSO4溶液,回答下列问题:
 ①用电子天平(如右图)称取硫酸铜晶体时读数应是
g 。
①用电子天平(如右图)称取硫酸铜晶体时读数应是
g 。
(该天平最小读数是1mg,不需估读)
②使用容量瓶配制溶液时,下列情况会使所配溶液浓度偏低的是_________________。
A.称重前发现晶体有风化(失去部分或全部结晶水)的现象
B.移溶液前容量瓶内有少量蒸馏水
|
D.定容时,俯视容量瓶的刻度线
E.容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
20.(共12分)某研究性学习小组对“氢硫酸长期存放会变浑浊”十分感兴趣,为了探究其原因,他们分别做了如下实验:
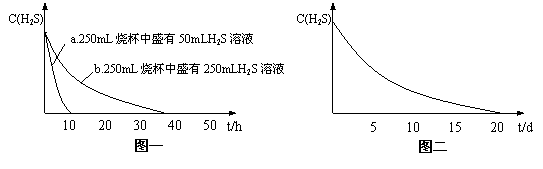 实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中敞口放置1~2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中敞口放置1~2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
 实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,
用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,
用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。
实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1~2个气泡/min),数小时未见变浑浊的现象。
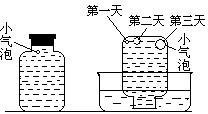 实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2~3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2~3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现更明显些。
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2~3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2~3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现更明显些。
请回答下列问题:
(1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是_______________。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为_______________。两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应。___________________________________。
(3) “氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了_______的缘故。
(4)该研究性学习小组设计实验三说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明)______________________。此实验中通入空气的速度很慢的主要原因是什么?________________________________。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是_________。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?_____________________________________。
四、(本题包括2小题,共22分)
21.(14分)(1)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
①该反应中的还原剂是 该反应中,发生还原反应的过程是 → 。
②写出该反应的化学方程式,并标出电子转移的方向和数目:
![]() ③在H2O2中加入乙醚(溶剂,不参与反应)后,再加入数滴K2Cr2O7的硫酸溶液,轻轻振荡后静置,乙醚层呈现现蓝色,这是由于生成的CrO5溶于乙醚的缘故。已知CrO5是含有过氧键(-O-O-)的共价化合物,且Cr的化合价为+6。
③在H2O2中加入乙醚(溶剂,不参与反应)后,再加入数滴K2Cr2O7的硫酸溶液,轻轻振荡后静置,乙醚层呈现现蓝色,这是由于生成的CrO5溶于乙醚的缘故。已知CrO5是含有过氧键(-O-O-)的共价化合物,且Cr的化合价为+6。
a.在1mol CrO5中过氧键(-O-O-)的物质的量为________,
 请在右面的方框中画出其结构式。
请在右面的方框中画出其结构式。
b.写出这一反应的离子方程式________________________
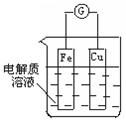
(2) 如图所示,组成一个原电池。①当电解质为稀硫酸时:
电极Fe上的电极反应为 ;
②当电解质为稀硝酸时:电极Cu上的电极反应为____ 。
![]() 22.(8分)有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5molA、0.5molB和3molC,将两容器的温度恒定在770K,使反应
22.(8分)有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5molA、0.5molB和3molC,将两容器的温度恒定在770K,使反应
3A(g)+B(g) xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x= ,若平衡时,甲、乙两容器中A的物质的量不.相等,则x= 。
(2)平衡时,甲、乙两容器中A、B的物质的量之比是否相等 (填“相等”或“不相等”),平衡时甲中A的体积分数为 。
(3)若平衡时两容器中的压强不相等,则两容器中压强之比为 。
五、(本题包括2小题,共18分)
23.(8分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现 用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:
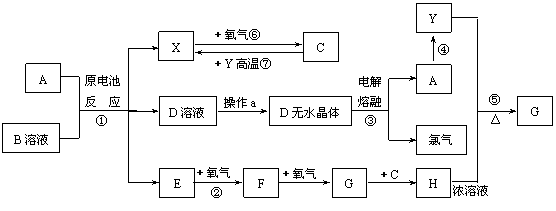 (注意:其中有些反应的条件及部分生成物被略去)
(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为 。
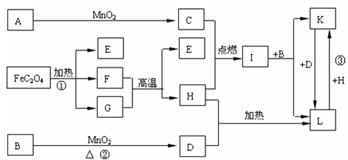 24.(10分)下列A—L 11种物质是中学化学常见物质,其中C、D、E、F为气体,C、D、H为单质。1 mol FeC2O4在反应①中转移1 mol电子。它们有如下图所示的转化关系(部分反应中的生成物已略去),试回答:
24.(10分)下列A—L 11种物质是中学化学常见物质,其中C、D、E、F为气体,C、D、H为单质。1 mol FeC2O4在反应①中转移1 mol电子。它们有如下图所示的转化关系(部分反应中的生成物已略去),试回答:
(1) 写出有关物质的化学式:A__________、E__________、I____________。
(2) 写出反应①中化学方程式_____________________________________________。
(3)写出反应②中化学方程式_____________________________________________。
(4) 写出反应③中的离子方程式 。
六、(本题包括2小题,共14分)
25. (6分)将12.6克无水亚硫酸钠固体加入100 mL 8 mol·L-1的硫酸中以制取SO2气体,反应完全后,若溶液中含+4价硫元素的物质的总浓度为0.2 mol·L-1,假定溶液体积不变,忽略容器及导管中的气体体积,求:
(1)反应完全后溶液中硫元素的质量.
(2)收集到SO2气体的体积(标准状况下)。
26. (8分)铁粉和铜粉的均匀混合物,平均分成三等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
| 编号 | ① | ② | ③ |
| 稀硝酸体积/mL | 100 | 200 | 300 |
| 剩余金属/g | 30.4 | 22 | 12.8 |
| NO体积/mL | 2240 | 4480 | 6720 |
由上述数据推测:
(1)求硝酸的物质的量浓度。
(2)③中比②中多溶解金属的成分是什么?其相应的质量为多少克?
(3)向反应后的①中加入足量的该稀硝酸时,又生成气体的体积在标准状况下为多少L?
高三化学综合练习(五)答案:
一、二1.B 2.C 3.C 4.D 5.D 6.D 7.A 8.D 9.AC 10.C 11.CD 12.AD 13.C 14.A 15.BD 16.BC 17.B 18.BC
三、(本题包括2小题,共22分)
19.(10分)(1) ①B 白色沉淀也可能是氯化银(3分) ②D 具有这一实验现象的也可能是亚硫酸根等离子 (3分) (2)2.500 CE (4分)
20.(12分)(1)硫化氢的挥发(2分)
(2)H2S+I2==2HI+S↓(1分)向氢硫酸中加入淀粉液,滴加碘水到溶液刚好呈蓝色。(2分)
(3)S或硫(1分) (4)氢硫酸被空气中氧气氧化(1分)防止因通入空气过快而使硫化氢大量挥发(2分) (5)硫化氢自身分解(1分)确证生成的气体是氢气(2分)
21.(14分)⑴ ①H2O2 H2CrO4 Cr(OH)3
②
③a.2mol b .Cr2O72-+4H2O2+2H+=2 CrO5+5H2O
(2) ① Fe-2e-=Fe2+ ; ②4H++NO![]() +3e-=NO↑+2H2O
+3e-=NO↑+2H2O
22. (10分) (1) 2 (2分) 4 (2分) (2)相等(2分) 0.6(2分) (3)8:5(2分)
五、(本题包括2小题,共18分)
|
(3)②4NH3+5O2 = 4NO+6H2O (4)⑤C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
|
(5)2NH4++2e- = 2NH3↑+H2↑
24. (10分) (1) H2O2 CO2 Fe3O4 (各1分)
(2) FeC2O4![]() CO↑+CO2↑+FeO (3分)
CO↑+CO2↑+FeO (3分)
(3) 4 HCl + MnO2
![]()
![]() MnCl2 + Cl2 ↑ + 2H2O (2分)
MnCl2 + Cl2 ↑ + 2H2O (2分)
(4) 2Fe3+ + Fe = 3 Fe2+ (2分)
六、(本题包括2小题,共14分)
25(共6分) (1)m(S)=0.2mol/L×0.1L×32g/mol+0.8mol×32g/mol=26.2g (3分)
(2)n(Na2SO3)=12.6g÷126g·mol—1=0.1mol
n(SO2)=0.1mol一0.2mol/L×0.1L=0.08mol
V(SO2)=0.08mo1×22.4L/mol=1.792L 即 1792mL (3分)
26.(8分)(1)3M + 8HNO3 = 3M(NO3)2 + 2NO‹+ 4H2O
8 2
0.4 2240/22400=0.1
(2)CHNO3=4mol/L
(3)由表中数据可知,剩余金属①②相差8.4g ,②③ 相差9.2g ,所以③中肯定溶解了铁和铜,
设③中比②中多溶解的铁的物质的量为x ,多溶解的铜的物质的量为y
![]()
![]() x
+ y =2240/22400 ×1.5
x=0.05 mol
x
+ y =2240/22400 ×1.5
x=0.05 mol
56x + 64y =22-12.8 y=0.1 mol
m(Fe)=0.05×56=2.8g
m(Cu)=0.1×64=6.4g
![]() (4)Fe的总质量为=30.4+8.4-19.2=19.6g 0.35
mol
(4)Fe的总质量为=30.4+8.4-19.2=19.6g 0.35
mol
![]() Cu的总质量为=12.8+6.4=19.2g 0.30
mol
Cu的总质量为=12.8+6.4=19.2g 0.30
mol
Fe――-NO 3Cu―――― 2 NO
气体的总物质的量为0.35+0.30×2/3=0.55 mol
所以又生成气体的物质的量为0.55-0.10=0.45 mol,
标况下体积为0.45×22.4=10.08 L