高三化学综合训练题(1)
本试卷考试时间:100分钟; 满分:100分。
本试卷可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶1 6 Na∶23 S∶32
Fe∶56 Cu∶64
第Ⅰ卷(选择题,每小题只有一个选项符合题意,共54分)
1、据报道,用激光将置于铁室中的石墨靶上的碳原子“炸松”,与此同时再用一个射频电火花喷射出氮气,此时碳、氮原子结合成碳氮化合物的薄膜,该膜的硬度比金刚石更大,其原因可能是①碳、氮原子构成网状的原子晶体;②相邻主族非金属的化合物比单质硬度大;③碳、氮都是非金属,化合时放出大量热;④膜中的C—N键比金刚石的C—C键更牢固
A、①② B、②③ C、③④ D、①④
2、下列反应在加入少量物质后,反应速度将加快,但该反应不属于催化反应的是
A、在苯和液溴的混合物中加入少量铁屑
B、在锌粒和稀硫酸的混合物中加入少量硫酸铜
C、在过氧化氢溶液中加入少量二氧化锰
D、在镁粉和稀盐酸的混合物中加入少量醋酸钠
3、最近,科学家用一种称为“超酸”的化合物H[(CB11H6Cl6)]和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]—。该反应看起来很陌生,其实在反应类型上可以跟中学化学里某个熟悉的化学反应相比拟。该化学反应是
A、Zn + 2HCl ===
ZnCl2 + H2↑ B、H2O + CH3COOH![]() H3O+ + CH3COO—
H3O+ + CH3COO—
C、NH3 + HCl === NH4Cl D、CO2 + 2NH3 === CO(NH2)2 + H2O
|
A、Ⅰ和Ⅲ B、Ⅰ和Ⅳ C、Ⅱ和Ⅲ D、Ⅱ和Ⅳ
5、某共价化合物含碳、氢、氮三种元素,分子内有4个氮原子,且4个氮原子排列成内空的四面体(如白磷结构),每两个氮原子间都有一个碳原子。已知分子内无C-C键和C=C键,则该化合物的分子式为
A、CH8N4 B、C4H8N4 C、C5H10N4 D、C6H12N4
6、实验室制备下列物质过程中可能引入杂质,能用NaOH溶液和浓硫酸进行除杂并干燥的是
A、实验室用二氧化锰和浓盐酸制氯气 B、实验室制乙烯
C、乙醇和乙酸制备乙酸乙酯 D、铜片和浓硝酸制取二氧化氮
7、2002年12月31日,世界上第一条商业磁悬浮铁路在上海投入运营。磁悬浮的核心技术是利用超导体的反磁性。以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3Ox。现欲合成0.5 mol此高温超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量(mol)分别为
A、0.50、0.50、0.50 B、0.50、1.0、1.5 C、0.25、1.0、1.5 D、1.0、0.25、0.17
8、pH=1的酸和pH=13的NaOH溶液中分别加入足量的铝,放出H2的量前者多,原因可能是①两溶液体积相同,酸是多元强酸;②两溶液体积相同,酸是一元弱酸;③酸溶液的体积大于NaOH溶液的体积;④酸是强酸,浓度比NaOH溶液大。其中正确的是
A、①② B、②③ C、③④ D、①④
9、将a molN2O4晶体在密闭容器中加热汽化,达到平衡时容器中有b mol气体,则N2O4的转化率及平衡混合气体的平均相对分子质量分别为
A、![]() ;
;![]() B、
B、![]() ;
;![]()
C、![]() ;
;![]() D、
D、![]() ;
;![]()
10、A、B分别为第三周期、第四周期同一主族的不同元素的原子,它们原子核内质子数均等于中子数。若A为ⅡA 族,其质量数为x,则B的质子数为Z,若A为ⅣA族,其质子数为y,则B的质量数为N。Z和N分别为下列哪一组值
A、0.5x+18;2y+18 B、2y+18;0.5x+8 C、0.5x+8;2y+36 D、2y+36;0.5x+18
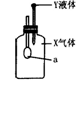 11、如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体
11、如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体
Y滴入瓶中,振荡,一会儿可见小气球a鼓起。气体X和液体Y不可能是
A、X是NH3,Y是水 B、X是CO2,Y是稀H2SO4
C、X是SO2,Y是NaOH溶液 D、X是HCl,Y是NaNO3溶液
12、下列离子方程式书写正确的是
A、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2 === CaCO3↓+2HClO
B、钠投入硫酸铜溶液中: Na+Cu2++2H2O === Na++Cu(OH)2↓+H2↑
C、向碳酸钠溶液中缓慢滴入几滴稀盐酸并不断搅拌: CO32-+H+=== HCO3-
D、硫酸镁溶液中加入氢氧化钡溶液: SO42-+Ba2+=== BaSO4↓
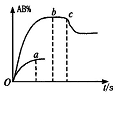 13、如图表示反应A2+B2
13、如图表示反应A2+B2![]() 2AB在不同温度和压强改变的条件下产物AB的物质的量随时间的变化关系。a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间t3开始向容器中加压的情况。则下列叙述正确的是
2AB在不同温度和压强改变的条件下产物AB的物质的量随时间的变化关系。a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间t3开始向容器中加压的情况。则下列叙述正确的是
A、A2、B2及AB均为气体,△H<0
B、AB为气体,A2、B2中至少有一种为非气体,△H<0
C、AB为气体,A2、B2中有一种为非气体,△H>0
D、AB为固体,A2、B2中有一种为非气体,△H<0
14、有机物L的分子式为C3H6O2,水解后得到一元酸M和一元醇N。已知M、N的相对分子质量相等,则下列叙述中不正确的有
A、M、N互为同分异构体 B、L、M都具有还原性
C、M与软脂酸互为同系物 D、N能与水以任意比互溶
15、设NA表示阿伏加德罗常数,下列说法不正确的是
A、0.1molNa在一定条件下与O2反应,当生成Na2O和Na2O2时,失去电子的数目为0.1NA
B、标准状况下,4.48L SO3中含有硫原子数目为0.2NA
C、常温常压下,氧气和臭氧的混合物16g中含有氧原子数目为NA
D、1molC10H22分子中共价键总数为31NA
16、拉曼光谱表明溶液中不存在AlO2-离子,实际存在[Al(OH)4]-离子。0.2mol/LNa[Al(OH)4]溶液200mL与0.2mol/L H2SO4溶液250mL混合,完全反应后,溶液中Al3+与SO42-离子的物质的量之比约为
A、4∶5 B、2∶3 C、1∶2 D、2∶5
17、在某稀溶液中含4molKNO3和2.5molH2SO4,向其中加入1.5molFe粉,充分反应后产生的气体在标况下的体积为
A、36L B、28L C、22.4L D、11.2L
18、某温度下Na2CO3饱和溶液的质量分数为a%,向其中加入m mol Na2CO3·5H2O或n mol无水Na2CO3,可析出相同质量的Na2CO3·10H2O,下列判断正确的是
A、a可能为40;m>n B、a可能为40;m=n
C、a可能为30;m>n D、a可能为30;m<n
高三化学综合训练题(1)
答 题 卷
班级 姓名 学号 得分
第Ⅰ卷(选择题,每小题只有一个选项符合题意,共54分)
| 题号 | l | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(非选择题,共46分)
|
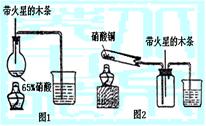
Ⅰ.实验装置如下图1所示:
(1)浓硝酸受热分解的化学方程式是
。
(2)实验开始后木条上的火星逐渐熄灭,有的同学得出
“NO2
不能支持木条的燃烧”的结论。你认为这一结论是否正确?
并说明理由:
。
Ⅱ.实验装置如上图2所示:
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,该反应的化学方程式是
。
(2)当集气瓶中充满红棕色气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?并说明理由是
。
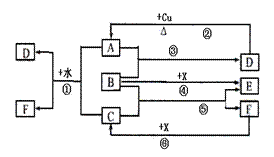 20、(8分)已知A~F是中学化学中常见的物质,其中A、C、E、F为气体,B、D为液体,D是一种重要化工原料,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。试回答下列问题:
20、(8分)已知A~F是中学化学中常见的物质,其中A、C、E、F为气体,B、D为液体,D是一种重要化工原料,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。试回答下列问题:
(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是 。(用对应物质的化学式表示)
(2)B的电子式: 。
(3)写出反应②的化学方程式:
。
(4)写出反应①、⑥的离子方程式分别为:
① 。
② 。
21、(8分)A、B、C、D均为短周期主族元素,B、A可形成两种液态化合物,其原子个数比分别为1∶1和2∶1,且分子中电子总数分别为18和10;B与D能形成一种极易溶于水的气体X,X的水溶液呈碱性,X分子可以结合一个质子形成阳离子Z。B与C能形成极易溶于水的气体Y,Y的水溶液呈酸性。Y分子中的电子数为18,A、B、D形成离子化合物,其化学式为B4A3D2,其水溶液呈弱酸性:请回答:
(1)元素符号A: ; B: ; C: ; D: 。
(2)X分子空间构型为 ;Y分子的极性为 (极性分子或非极性分子)。
(3)将38.4g铜跟足量的BDA3的浓溶液反应,铜全部作用后,共收集气体22.4L(标准状况),则反应消耗BDA3的物质的量是 。
(4)解释B4A3D2水溶液呈酸性的离子方程式为: 。
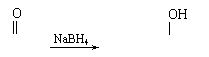 22、(10分)“蜂黄酸”Q只含碳、氢、氧三种元素,分子中碳、氢、氧原子个数比为10∶16∶3,Q具有酸性;1molQ需要1mol氢氧化钠完全中和。1molQ可以和1molBr2加成,经测定Q的相对分子质量不大于200,各有机物的转化关系如图所示。
22、(10分)“蜂黄酸”Q只含碳、氢、氧三种元素,分子中碳、氢、氧原子个数比为10∶16∶3,Q具有酸性;1molQ需要1mol氢氧化钠完全中和。1molQ可以和1molBr2加成,经测定Q的相对分子质量不大于200,各有机物的转化关系如图所示。
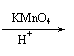 已知:① CH3—C—R
CH3—CH—R;
已知:① CH3—C—R
CH3—CH—R;
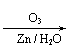 ②R—CH
②R—CH CH—R’ R—COOH + R’—COOH
③R—CH CH—R’ R—CHO + R’—CHO

(1)写出Q的分子式 。Q在转化过程中能发生氧化反应的官能团为 。(写名称)
(2)在①、②、③、④步的化学反应中属于消去反应的是 ,属于氧化反应的是 。
(3)反应④的化学方程式为 。(有机物写结构简式)
(4)写出下列物质的结构简式
Q: ; G: 。
23、(6分)2003年10月16日“神舟”五号飞船成功发射,实现了中华民族的飞天梦想。运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的分子式和电子式分别为 和 。
(2)若64 g该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000 kJ的热量。写出该反应的热化学方程式为 。
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl===NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的化学方程式为 。
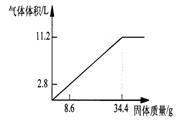 24、(6分)在100mLNaOH溶液中加入NH4NO3
和(NH4)2SO4
的固体混合物,加热使之充分反应,下图表示加入固体的的质量与产生气体的体积(标准状况)的关系。试计算:
24、(6分)在100mLNaOH溶液中加入NH4NO3
和(NH4)2SO4
的固体混合物,加热使之充分反应,下图表示加入固体的的质量与产生气体的体积(标准状况)的关系。试计算:
(1)NaOH溶液的物质的量浓度是 mol·L-1。
(2)当NaOH溶液为140mL,固体为51.6g时,充分反应产生的气体为
L(标准状况)。
(3)当NaOH溶液为180mL,固体仍为51.6g时,充分反应产生的气体
为 L(标准状况)。
高三化学综合训练题(1)
参考答案
第Ⅰ卷(选择题,每小题只有一个选项符合题意,共54分)
| 题号 | l | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | B | C | B | D | B | C | B | D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | B | C | B | A | B | D | B | A |
![]() 第Ⅱ卷(非选择题,共46分)
第Ⅱ卷(非选择题,共46分)
19、(8分)Ⅰ.(1)4HNO3(浓) 4NO2↑+O2↑+2H2O
![]() (2)不正确,带火星的木条熄灭可能是由于加热浓硝酸时产生大量水蒸气。
(2)不正确,带火星的木条熄灭可能是由于加热浓硝酸时产生大量水蒸气。
II.(1)2Cu(NO3)2 2CuO+4NO2↑+O2↑
(2)正确,硝酸铜分解产生的混合气体中氧气的体积分数与空气中氧气的体积分数基本相同,若NO2不支持燃烧,则木条不会复燃。
|
|
|
![]()
|
![]() (3)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
(3)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
(4)Cl2+SO2+2H2O 4H++SO42-+2Cl-; MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
21、(8分)(1)A:O;B:H;C:Cl;D:N。 (2)三角锥形;极性分子。
![]() (3)2.2mol;
(4)NH4++H2O NH3·H2O+H+。
(3)2.2mol;
(4)NH4++H2O NH3·H2O+H+。
22、(10分)(1)C10H16O3,碳碳双键 (2)②,④
(3)CH3CHO+2[Ag(NH3)2]OH ![]() CH3COONH4+2Ag↓+3NH3+H2O
CH3COONH4+2Ag↓+3NH3+H2O
![]() O
O
(4)Q:CH3—C—(CH2)5—CH===CH—COOH
![]()
![]() O
O
![]()
![]() G:CH3—CH C===O
G:CH3—CH C===O
(CH2)5
![]()
23、(6分)(1) N2H4;
(2)N2H4(1)+2H2O2(1)===N2(g)+4H2O(g);ΔH=-1500kJ·mol-1
(3)N2H4+2HCl===N2H6Cl2
24、(6分)(1)5 mol·L-1 (2)15.68L (3) 16.8L