高三化学综合训练题(2)
本试卷考试时间:100分钟; 满分:100分。
本试卷可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶1 6 Na∶23 Mg∶24 S∶32
Cl∶35.5 K∶39 Ca∶40 Fe∶56 Zn∶65
第Ⅰ卷(选择题,每小题只有一个选项符合题意,共54分)
1、已知钡的金属活动性处于钾和钠之间,下列反应可以实现的是
A、钡可以从氯化钾溶液中置换出钾
B、钡可从冷水中置换出氢而得氢气
C、钡可从氯化钠溶液中置换出钠
D、在溶液中钡离子可以氧化金属锌
2、加热碳酸钙和碳酸镁组成的混合物至质量不再减少,称得残留物的质量为原混合物的一半,则混合物中钙与镁的物质的量之比为
A、1∶1 B、2∶1 C、1∶3 D、3∶1
3、沼气是一种能源,它的主要成分为甲烷。0.5 mol CH4完全燃烧生成CO2、H2O,放出445 kJ热量,则热化学反应方程式正确的是
A、2CH4(g) + 4O2(g)→2CO2(g) + 4H2O(l);△H=+890kJ / mol
B、CH4(g) + 2O2(g)→CO2(g) + 2H2O(l);△H=+890kJ / mol
C、CH4(g) + 2O2(g)→CO2(g) + 2H2O(l);△H=-890kJ / mol
D、![]() CH4(g) + O2(g)→
CH4(g) + O2(g)→![]() CO2(g) + H2O(l);△H=-890kJ / mol
CO2(g) + H2O(l);△H=-890kJ / mol
4、下列离子方程式书写正确的是
A、等物质的量浓度的FeI2溶液与溴水等体积混合:2Fe2+ + 2I- + 2Br2 == 2Fe3+ + I2 + 4Br-
B、用氨水吸收少量的SO2:2NH3·H2O + SO2 == 2NH4+ + SO32- + H2O
C、铜与浓硝酸反应:Cu + 2H+ + 2NO3-==Cu2+ + 2NO2↑+ H2O
D、NaHSO4溶液与过量的Ba(OH)2反应:H+ + OH- == H2O
5、市售“家用消毒液发生器”是以精盐和自来水为原料,通电时发生器内的电极板上产生大量气泡(同时使产生的气体充分与电解液接触)所制得的混合液具有强烈的杀菌能力,且不对人体造成伤害。该发生器消毒液所涉及的化学反应有
①2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
②Cl2+2NaOH==NaCl+NaClO+H2O ③H2+Cl2==2HCl
④Cl2+H2O==HCl+HClO ⑤2HClO==2HCl+O2 ↑
A、①②④ B、①④⑤ C、②③④ D、③④⑤
6、下列分子中的所有原子不可能同时处于同一个平面上的是
A、苯乙烯
![]() B、苯甲酸
B、苯甲酸 ![]()
C、联苯
![]() D、苯胺
D、苯胺 ![]()
7、下列表示一种有机物的结构,关于它的性质的叙述中不正确的是
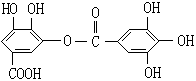 A、它有酸性,能与纯碱溶液反应
A、它有酸性,能与纯碱溶液反应
B、可以水解,水解产物只有一种
C、1 mol该有机物最多能和7 mol NaOH反应
D、该有机物能与溴水发生取代反应
8、A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A顺序依次减小,B和E同主族。下列推断中不正确的是
A、A、B、E一定在不同周期
B、C元素的最高价氧化物对应的水化物可能显碱![]()
![]()
![]() 性
性
C、A、D可能在同一主族
D、C和D单质化合可能形成离子化合物
9、a mol FeS与b mol FeO投入到V L c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作Fe(NO3)3、H2SO4混合液,则反应中未被还原的硝酸可能为
①(a+b)×63 g ②(a+b)×189 g
③(a-b)mol
④(![]() ) mol
) mol
A、①② B、②③ C、①④ D、②④
10、某有机物分子中只含C、H、O、N四种元素,并且只有1个N原子。已知该化合物中氢原子数为13,则碳原子数最少等于
A、6 B、5 C、4 D、不能确定
11、最近发现纳米材料具有很多优越性能,有着广阔的应用前景。已知1nm(纳米)=10-9m,边长为1 nm的立方体内可容纳的液态氢分子(其直径约为10-10m)的个数最接近下面的哪一个数值?
A、102 B、103 C、105 D、109
12、一个12C原子的质量为a kg , 1个12CO2分子的质量为b kg,若以12CO2分子中一个氧原子质量的1/16作原子质量标准,则12CO2的相对分子质量为
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
13、在一定条件,NO跟NH3可发生反应生成N2和H2O。现有一定量的NO和NH3的混合气体恰好完全反应,所得产物中还原产物比氧化产物多2.8g,则原混合气体中NO和NH3总的物质的量为
A、0.25 mol B、0.5 mol C、1 mol D、2 mol
14、将0.03 mol Cl2缓缓通入含0.02 mol H2SO3和0.02 mol HBr的混合溶液中(忽略溶液体积的变化),溶液中c(H+ )与通入的Cl2物质的量的关系图中,正确的是
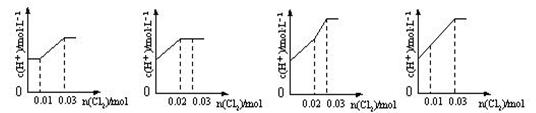
A、 B、 C、 D、
15、下列实验能达到预期目的的是
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸;②用NaOH溶液除去苯中的少量苯酚;③用饱和NaHCO3溶液除去CO2中的少量SO2;④用加热的方法提取NH4Cl固体中混有的少量碘;⑤用醋和澄清石灰水验证蛋壳中含有碳酸盐;⑥用米汤检验食用加碘盐中含碘;⑦用碘酒验证汽油中含有不饱和烃
A、①②⑥⑦ B、①③⑤⑥⑦ C、②③⑤⑦ D、②③④⑤⑦
16、标准状况下,向3 mol·L-1的NaOH溶液100mL中缓缓通入4.48LCO2气体,充分反应后溶液中离子浓度大小排列顺序正确的是
A、c(Na+) > c(CO32-) > c(HCO3-) > c (OH-) > c(H+)
B、c(Na+) > c(CO32-) = c(HCO3-) > c (OH-) > c(H+)
C、c(Na+) > c(HCO3-) > c (OH-) > c(CO32-) > c(H+)
D、c(Na+) > c(HCO3-) > c(CO32-) > c (OH-) > c(H+)
17、将2.4 mol某金属投入1.8L 2 mol·L-1的某酸溶液中,恰好完全反应并放出7.2g H2,则该金属和酸分别是
A、三价金属和二元酸 B、二价金属和三元酸
C、二价金属和二元酸 D、一价金属和一元酸
18、将pH=1的盐酸平均分成2份,一份加适量水,另一份加入与该盐酸的物质的量浓度相同的NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比约为
A、9 B、10 C、11 D、12
高三化学综合训练题(1)
答 题 卷
班级 姓名 学号 得分
第Ⅰ卷(选择题,每小题只有一个选项符合题意,共54分)
| 题号 | l | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(非选择题,共46分)
19、(9分)已知在一定条件下,下列反应可以发生:R—CH==CH—R'R—CHO+R—CHO。转化中A、E为同分异构体且均能与Na2CO3反应产生CO2,F是含六元环的化合物。
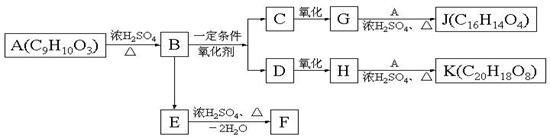
(1)写出结构简式:H:_______________;J:_____________________。
(2)写出下列反应化学方程式A→B:__________________________ _____。
20、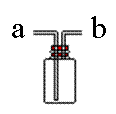 (10分)右图所示装置为化学实验中常见的仪器,它除了用于洗气外,
(10分)右图所示装置为化学实验中常见的仪器,它除了用于洗气外,
还有其他用途。
(1)医院给病人输氧时往往在氧气罐与病人呼吸器之间安装盛水的该装置,
通过观察气泡产生情况以便调节供氧速率,此时氧气从___________瓶口导入。
(2)实验室用MnO2和浓HCl制Cl2实验中,将生成的Cl2通入NaOH溶液之前,先将Cl2从该装置__________管进,从_________管导出,此时该装置起的作用是防止NaOH倒流。
(3)当用此装置收集NO时,需采取的措施是__________________ ____________________。
21、(9分)观察A~F间的反应图示,回答下列问题。

(1) A是__________,E是__________。
(2)D跟水反应的化学方程式是__________________________ _____。
(3)C电解每生成1molA的同时生成____________molE。
22、7分)2000年在河南发现世界级特大金红石(含TiO2)矿床,这一发现具有重大战略意义 ,钛元素被称作21世纪的金属。
(1)钛元素的同位素有 下列说法中正确的是___________________。
A、钛的核内中子数比质子数多 B、钛的相对原子质量为48
C、钛在周期表中位于第四周期 D、钛属于V III族元素
(2)TiO2是高级白色颜料,可用下列反应制得:
第一步:FeTiO3 + 2H2SO4 === TiOSO4 + FeSO4 + 2H2O;△H<0
第二步:TiOSO4 +2H2O
![]() TiO2·H2O + H2SO4;△H>0
TiO2·H2O + H2SO4;△H>0
制取TiO2关键是第二步,为使该步顺利进行,可采用____________、____________、___________等措施。
(3)TiO2制成的纳米微粒对许多化学反应具有光催化作用,能吸收紫外线。以下对TiO2纳米微粒的用途的说法中肯定正确的是 ____________ (只有一个选项符合题意)
A、含有机物的废水进行处理 B、可制成抗菌防霉变的薄片
 C、可制防晒霜
D、用于汽车尾气的净化处理
C、可制防晒霜
D、用于汽车尾气的净化处理
(4)最近发现一种由钛、碳两种原子组成的气态团簇分子,分子模型
如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是
碳原子,这种分子的化学式是_______________。
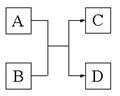 23、(11分)已知A、B、C、D分别代表中学化学常见物质(或微粒),
23、(11分)已知A、B、C、D分别代表中学化学常见物质(或微粒),
其中A、B均为两种元素组成的化合物(或微粒),相互转化关系见
右图(有关反应条件已略去)。请根据题目要求回答下列问题:
(1)若A、B两化合物相互反应得到气体单质C和化合物D,
则化学方程式为(只写一个): ______
_。
(2)若A、B两化合物相互反应生成非金属固体单质C和化合物D,且A的相对分子质量大于B,则该反应中氧化产物与还原产物的物质的量之比为 。
(3)若A为5个原子构成的微粒,且A、B均为10电子微粒,含适量A、B微粒的溶液在加热条件下反应生成气体C和化合物D,则A微粒的电子式为___________,C分子的空间构型为_________,含A、B微粒的溶液转化为C、D的离子方程式为__________________________________。
高三化学综合训练题(2)
参考答案
第Ⅰ卷(选择题,每小题只有一个选项符合题意,共54分)
| 题号 | l | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | C | C | B | A | D | C | B | D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | B | A | C | B | C | D | A | C |
第Ⅱ卷(非选择题,共46分)
19、(7分)(1)H:![]() (2分);
(2分);
J:
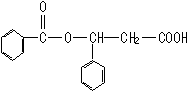 (2分)
(2分)
(2)
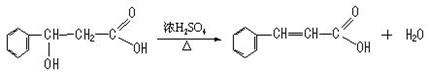 (3分)
(3分)
20、(10分)(1)a (2分); (2)b;a (每空2分)。
(3)先将瓶中充满水,再将气体从b管进,使水从a管压出而收集NO (4分)。
21、(9分)(1)A:Al; E:O2 (每空2分)。
![]() (2)
(2)
(3分)。
(3)0.75 (2分)。
22、(9分)(1)A、C (2分)。 (2)加温、加水、加碱 (3分)。
(3)C (2分)。 (4)Ti14C13 (2分)。
23、(11分)(1)2Na2O2+2H2O === 4NaOH+O2↑ 或2Na2O2+2CO2 === 2Na2CO3+O2↑
(答案合理均可) (3分)。
(2)2∶1 (2分)。
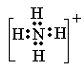 (3)
; 三角锥型
(3)
; 三角锥型
|
NH++OH-==== NH3↑+H2O (每空2分)