高三阶级性练习化学试卷
命题人:胡国栋
一、选择题(每一小题只有一个选项正确,每小题3分,共60分)
1.近年来,冠以“绿色”的新概念不断产生。“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是( )
A.Mg![]() Mg(NO3)2
Mg(NO3)2
B.Mg![]() MgCl2
MgCl2![]() Mg(OH)2
Mg(OH)2![]() Mg(NO3)2
Mg(NO3)2
C.Mg![]() MgO
MgO![]() Mg(NO3)2
Mg(NO3)2
D.Mg![]() MgSO4
MgSO4![]() Mg(NO3)2
Mg(NO3)2
2.在FeCl3溶液中滴加无色的KSCN溶液后有以下可逆反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,已知Fe(SCN)3呈红色,则在该平衡体系中加少量KCl固体后,红色将( )
Fe(SCN)3+3KCl,已知Fe(SCN)3呈红色,则在该平衡体系中加少量KCl固体后,红色将( )
A.变深 B.变浅 C.不变 D.无法确定
3.现有4mol铝及足量稀HCl和稀NaOH溶液,欲将铝全部转化为Al(OH)3,所需HCl与NaOH的物质的量之和最少应是( )
A.6mol B.4mol C.16mol D.8mol
4.将铁和铝的混和粉未溶于过量盐酸中,通入足量氯气,再加入过量的NaOH溶液,最后溶液中大量存在的离子是( )
A.Na+ Fe2+ Cl- AlO2- B.Na+ Fe3+ Cl- OH-
C.Na+ Fe3+ Cl- AlO2- D.Na+ Cl- OH- AlO2-
5.表示下列变化的化学用语正确的是( )
A.NaHCO3的水解:HCO3-+H2O![]() H3O+ +CO32-
H3O+ +CO32-
B.金属铝溶于NaOH溶液:Al+2OH-=AlO2-+H2↑
C.钢铁吸氧腐蚀的正极反应式:4OH--4e-=O2+2H2O
D.1 L0.5 mol·L-1稀硫酸与1 L1 mol·L-1 NaOH溶液反应放出57.3 kJ的热:
H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l);△H=-114.6 kJ/mol
6.在恒温、恒容的密闭容器中进行反应 A(g)===B(g)+C(g),若反应物的浓度由2 mol·L-1降到0.8 mol·L-1需要20 s,那么反应物浓度再由0.8 mol·L-1降到0.2 mol·L-1所需要的时间为( )
A.10 s B.大于10 s C.小于10 s D.无法判断
7.将两个铂电极插入500毫升CuSO4溶液中进行电解, 通电一定时间后, 某一电极增重0.064克(设电解时该电极无氢气析出, 且不考虑水解和溶液体积变化). 此时溶液中氢离子浓度约为( )
A.4×10-3mol/L B.2×10-3 mol/L
C.3×10-3 mol/L D.1×10-3 mol/L
8.对某酸性溶液(可能含有Br—、SO42—、H2SO3、Mg2+)分别进行如下实验;
①加热时放出的气体可以使品红溶液褪色 ②加碱调至碱性后,产生白色沉淀
③加入氯水时,溶液显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br— B.SO42— C.H2SO3 D.Mg2+
![]() 9.如下图,向A充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于a L,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应,X (g)+ Y(g) 2 Z(g)+W(g);△H<0
。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L 。下列说法错误的是( )
9.如下图,向A充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于a L,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应,X (g)+ Y(g) 2 Z(g)+W(g);△H<0
。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L 。下列说法错误的是( )
 A.反应速率:v(B)
A.反应速率:v(B)![]() >v(A)
>v(A)
B.A容器中X的转化率为 80%
C.平衡时的压强:PB=2PA D.平衡时Y体积分数:A<B
10.将含有0.400molCuS04和0.200molKCl的水溶液lL,用惰性电极电解一段时间后在一个电极上析出19.2gCu,此时在另一电极上放出的气体在标准状况下的体积为( )
A.5.60L B.6.72L C.4.48L D.3.36L
11.广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法不正确的是( )
A.CaO2的水解产物是Ca(OH)2和H2O2 B.Al4C3的水解产物之一是CH4
C.PCl3的水解产物是PH3和HClO D.Mg3N2水解生成NH3和Mg(OH)2
12.常温时,向PH=2的盐酸中加入等体积的下列溶液后,滴入甲基橙试液出现红色,该溶液可能是( )
A.PH=12的氨水 B.0.05mol/LNaOH
C.0.05mol/LNa2SO4 D.PH=12的Ba(OH)2
13.常温下,浓度为0.1 mol/L的一元酸HA溶液的pH=2.0,浓度为0.1 mol/L的一元碱BOH溶液中![]() =1.0×10-12。将PH=2
HA和PH=12 BOH两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是( )
=1.0×10-12。将PH=2
HA和PH=12 BOH两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是( )
A.c(OH-)>c(H+)>c(B+)>c(A-) B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(B+)>c(A-)>c(OH-)>c(H+) D.c(B+)>c(A-)>c(H+)>c(OH-)
14.纳米材料是由纳米粒子(粒子直径 1 nm ~100nm)所组成的材料,它具有奇特的光、热、声、电、磁、力学和化学活泼性等理化性质.下列分散系中不含纳米粒子的是( )
A.血液 B.豆浆
C.无尘无雾含水蒸气的空气 D.一定量饱和NaCl(aq)滴入酒精中
15.甲、乙两同学从同一溶液中各取出100g做如下实验:甲将溶液蒸发掉20g水后冷却到室温,析出3.6g晶体(不含结晶水);乙将溶液蒸发掉30g水后冷却到室温,析出6.0晶体,若两同学实验都正确无误,则100g该溶液蒸发掉10g水并冷却到室温时,析出晶体的质量为( )
A.0 B.1.2g C.2.4g D.9.6g
![]() 16.一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1 0.08mol·L-1,则下列判断不合理的是( )
16.一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1 0.08mol·L-1,则下列判断不合理的是( )
A.c1:c2=1:3 B.平衡时,Y和Z的生成速率之比为2:3
C.X、Y的转化率相等 D.c1的取值范围为0<c1<0.14mol·L-1
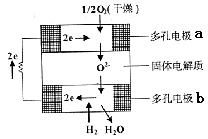 17.固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的。它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如右图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是
17.固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的。它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如右图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是
A.有O2放电的a极为电池的负极
B.有H2放电的b极为电池的正极
C.a极对应的电极反应为O2+2H2O+4e-=4OH-
D.该电池的总反应方程式为2H2+O2![]() 2H2O
2H2O
18.将a mol钠和a mol铝一同投入m g足量的水中,所得溶液的密度为dg·![]() 该溶液的质量分数为( )
该溶液的质量分数为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
![]()
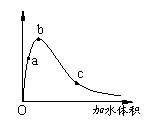 19.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是( )
19.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是( )
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<c<b
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢
氧化钠溶液体积:c<a<b
20.物质的的浓度、体积都相同的NaF和NaCN溶液中,离子总数的关系正确的是(已知HF比HCN易电离)( )
A.NaF=NaCN B.NaF>NaCN C.NaF<NaCN D.无法确定
二、填空题
21.(4分)有组成为AmBn的盐,已知AmBn不是弱酸和弱碱所生成的盐,AmBn溶于水后滴入酚酞试液呈红色,写出该盐的电离方程式和水解方程式:
22.(8分)反应aA(g) +bB(g) ![]() cC(g)+dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a∶b。则
cC(g)+dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a∶b。则
⑴平衡时A与B的转化率之比是 。
⑵若同等倍数地增大A、B的物质的量浓度,要使A与B的转化率同时增大,(a+b)与(c+d)所满足的关系是(a+b) (c+d) (填“>”“=”“<”或“没关系”)。
⑶设定a=2 ,b=1,c=3,d=2,在甲、乙、丙、丁4个相同的容器中:A的物质的量依次是2 mol、1 mol、2 mol、1 mol,B的物质的量依次是1 mol、1 mol、2 mol、2 mol,C和D的物质的量均为0。则在相同温度下达到平衡时,A的转化率最大的容器是 ,B的转化率由大到小的顺序是 (填容器序号)。
23.(8分)现有浓度为0.1 mol·L-1的五种电解质溶液①Na2CO3 ②NaHCO3 ③NaAlO2
④CH3COONa ⑤NaOH
已知:CO2+3H2O+2AlO2-===2Al(OH)3↓+CO32-
⑴这五种溶液的pH由小到大的顺序是 (填编号)
⑵将五种溶液稀释相同的倍数时,其pH变化最大的是 (填编号)
⑶在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是
(填编号)
⑷将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写
出该反应的离子方程式 。
24.(10分)根据下图推断填空:
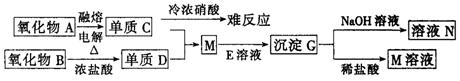
⑴C是 ,D是 ,G是
⑵写出下列反应的离子方程式:
B+浓盐酸 G+NaOH溶液

 高三阶级性练习化学答卷纸
高三阶级性练习化学答卷纸
一、选择题(每小题3分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
二、填空题
21.⑴
22.⑴
⑵
⑶
23.⑴
⑵
⑶
⑷
24.⑴C是 ,D是 ,G是
⑵B+浓盐酸
G+NaOH溶液
25. (9分)⑴下列实验操作错误的是 :
A、滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中液面
B、分液时分液漏斗中下层液体从下口放出,上层液体从上口倒出
C、容量瓶检漏的操作:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置,观察是否漏水
D、观察钾元素焰色反应:将铂丝放在稀盐酸中洗涤,然后蘸取固体碳酸钾,置于酒精灯的火焰上进行灼热,透过蓝色钴玻璃进行观察
E、将滴管垂直伸进试管内滴加液体
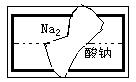 ⑵某中学学习小组在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损(如右图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计实验验证。
⑵某中学学习小组在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损(如右图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计实验验证。
①猜想:这种试剂可能是:
②实验验证:
 三、计算题
三、计算题
26. (5分)右图为某市售盐酸试剂瓶标签上的部分数据。问:
⑴该盐酸的物质的量浓度为多少?(列式计算)
⑵取该盐酸25.4mL与2.00mol/L的氢氧化钠溶液
100mL混合,再将混合后溶液稀释至1.00L,此时溶液
的pH约为多少?
27.(6分)将5.1g镁铝合金溶于60mL5.0mol· L-1H2SO4溶液中,完全溶解后再加入65mL10。0mol·L-1的NaOH溶液,得到沉淀的质量为9.7g,继续滴加NaOH溶液时沉淀会减少。
⑴当加入 mL NaOH溶液时,可使溶解在硫酸中的Mg2+和Al3+恰好完全沉淀。
⑵计算合金溶于硫酸时所产生的氢气在标准状况下的体积。