高三九月月考化学试卷
分数:110分 时间:90分钟 命题人:白艳滨
可能用到的相对原子质量:
一、选择题(下列各题只有1个选项符合题意。每小题2分,共计40分)
1.金属钾比金属铷:( d )
A..金属性强 B.还原性强 C.原子半径大 D.熔点高
2.在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是( B )
A.+4 B.+5 C.+6 D.+7
3.下列各组离子,能够在溶液中大量共存的是:( c )
A. pH=1的溶液中 Na+、 S2-、K+、 MnO4- B. pH=7的溶液中.Al3+、Cl-、SO42-、HCO3-
C. pH>7的溶液中 Na+、AlO2–、SO42-、K+ D. pH=0的溶液中Na+、、K+、Fe2+、ClO-
4.在NO2被水吸收的反应中,发生还原反应和发生氧化反应的物质,其质量比为( c )
A 3:1 B 1:3 C 1:2 D 2:1
5.在一定条件下,氯气与碘单质以等物质的量进行反应,可得到一种红棕色液体ICl,ICl有很强的氧化性,ICl跟Zn、H2O反应的化学方程式如下 2ICl+2Zn=ZnCl2+ZnI2 ICl+H2O=HCl+HIO 下列关于ICl性质的叙述正确的是( B )
(A).ZnCl2是氧化产物,又是还原产物 (B).ZnI2是氧化产物,又是还原产物
(C).ICl跟H2O的反应,ICl是氧化剂,H2O是还原剂
(D).ICl跟H2O的反应,是自身氧化还原反应
6.关于钠的叙述不正确的是( B )
A. 钠质软,其新切的表面容易失去光泽 B.极易和水反应,因为它的氧化性很强
C.钠与硫反应很剧烈,甚至发生爆炸 D.钠在氯气中燃烧,生成物不易潮解
7.在反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 中15mol CuSO4可氧化的P原子的物质的量为( C )
A.1.5mol B.5.5mol C.3mol D.2.5mol
8.下列反应的离子方程式正确的是:( C )
A . 碳酸氢钙溶液跟盐酸反应: Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
B. 向饱和偏铝酸钠溶液中通入过量 CO2气体: 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
C. 向饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液: Ca2++HCO3-+OH-=CaCO3↓+H2O
D. Fe2(SO4)3酸性溶液中通入足量硫化氢 Fe3++H2S=Fe2++S↓+2H+
9、在下列各物质中, 属于分子晶体且分子内只含极性共价键的是( C )
A.CO2 B.O2 C.NH4Cl D.Ar
10. 碳酸氢钠受热容易分解为碳酸钠。现加热5.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为( B )
A.3.38g B.4.16g C.4.58g D.4.41g
11.下列各组离子:(1)I-、ClO-、NO3-、H+ (2)Fe3+、Cu2+、SO42-、Cl- (3)SO32-、SO42-、Cl-、OH- (4)K+、NH4+、HCO3-、OH- (5)H+、K+、Al3+、HSO3- (6)Ca2+、Na+、SO42-、CO32- 在水溶液中能大量共存的是 ( )
A、(1)和(6) B、(3)和(4) C、(2)和(3) D、(1)和(4)
12.下列微粒①Al3+ ②Cl- ③N2 ④MnO4- ⑤CO2 ⑥H2O2 ⑦Fe2+ ⑧MnO42-
既具有氧化性又具有还原性的是(
B )
(A).①④⑤⑦ (B).③⑥⑦⑧ (C).④⑤⑥⑧ (D).①②③⑥
13.下列各组在溶液中反应,不管反应物量是多少,都能用同一离子方程式表示的是( C )
(A).FeBr2与Cl2
(B).Ba(OH)2与H3PO4
(C).HCl与NaHCO3 (D).Ca(HCO3)2与NaOH
14.将3.20g Cu跟30.0mL 10.0mol·L-1的HNO3充分反应,还原产物有NO和NO2.若反应后溶液中有a mol H+离子,则此时溶液中含NO3-离子的物质的量为( D )
(A) (a+0.5)mol (B)2 a mol (C)0.1 a mol (D)(a+0.1)mol
15.下列对化学反应中能量变化的叙述,正确的是( B )
A. 稀盐酸与铝片反应温度升高,该反应是吸热反应
B. 将Ba(OH)2• 8H2O与NH4Cl混合研磨发生吸热反应
C. 反应物总能量低于生成物的总能量时,该反应不能发生
D. 当反应物总能量高于生成物的总能量时,所发生的反应是吸热反应
16.将铁和三氧化二铁的混合物2.72克加入50毫升1.6摩 / 升的盐酸中,恰好完全反应,滴入KSCN溶液后不显红色。若忽略化学反应中溶液体积的变化,则在所得的溶液中,Fe2+离子的物质的量浓度为( )
A.0.2摩 / 升 B.0.4摩 / 升 C.0.8摩 / 升 D.1.6摩 / 升
17.等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的![]() (同温同压),这时混合气体中N2、O2、CO2物质的量之比为
( A )
(同温同压),这时混合气体中N2、O2、CO2物质的量之比为
( A )
A. 3∶4∶1 B. 3∶3∶2 C. 6∶7∶3 D. 6∶9∶0
18.已知CH4(气) + 2O2(气) === 2H2O(液) + CO2(气) △H =--890.3kJ/mol
2H2O(液) === 2H2(气) + O2(气) △H=+571.6kJ/mol
那么,1gH2与1gCH4分别完全燃烧后,放出热量的数值之比约是( )
A.1∶3.4 B.1∶1.7 C.2.6∶1 D.4.6∶1
19.下列说法中正确的是( )
A.用酒精灯加热碳酸钠固体得到二氧化碳气体 B.钠在空气中燃烧得到白色氧化钠粉末
C.含有少量钾盐杂质的食盐其焰色反应显紫色
D.向碳酸钠饱和溶液中通入大量二氧化碳后析出碳酸氢钠晶体
20.为验证某混合气体中是否含有SO2,下列实验方案合理的是( C )。
A. 首先通入NaOH溶液中,再在溶液中加入BaCl2溶液,然后再加足量稀盐酸
B. 首先将气体通入酸性KMnO4溶液,再通入品红溶液,再通过BaCl2溶液
C.首先确定混合气体中有无其它还原性气体,如HI、HBr等,在排除这些气体的前提下,将混合气体通入酸性KMnO4溶液
D.首先将气体通入到品红溶液中,再设计实验证实是否含有Cl2等能使品红褪色的其它物质
二、选择题(下列各题只有2个选项符合题意。每小题3分,共计15分)
21.在一定条件下,SO2和H2S混合气体共2.5mol,充分反应后,测得还原产物比氧化产物少16g,则原混合气体中SO2与H2S的物质的量之比为 ( cd )
A.1:2 B.1:1 C.3:2 D.1:4
22.NaH是一种白色的离子晶体,其中钠为+1价,NaH与水反应放出氢气,下列叙述中,正确的是( BC )
(A).NaH在水中显酸性 (B).NaH中氢离子的电子排布与氦相同
(C).NaH中氢离子半径比锂离子半径大 (D).NaH中氢离子可被还原成氢气
23.将Na2O2固体加入到Ca(HCO3)2溶液中,下列有关说法正确的是( CD )
A.溶液中只有气体产生
B.溶液中只有沉淀产生
C.溶液中可能有反应:Ca2++OH-+HCO-3=CaCO3↓+H2O发生
D.溶液中可能有反应:Ca2++2OH-+2HCO-3=CaCO3↓+CO32-+2H2O发生
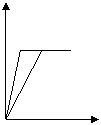 24. 少量的钠、钾投入一定量的稀盐酸中,产生气体随时间的变化的曲线如图所示,则下列说法中正确的是( BC
)
氢气质量(g)
A.投入的钠、钾一定等质量
b
24. 少量的钠、钾投入一定量的稀盐酸中,产生气体随时间的变化的曲线如图所示,则下列说法中正确的是( BC
)
氢气质量(g)
A.投入的钠、钾一定等质量
b
B.投入的钠的质量小于钾的质量 a
C.曲线a代表钠,曲线b代表钾
D.稀盐酸的量一定是不足量的
时间(s)
25.剧毒物氰化钠(NaCN)存在如下反应:
2NaCN+O2+2NaOH+2H2O→2Na2CO3+2NH3有关叙述正确的是( AD )
(A).氧气是氧化剂 (B).水是还原剂
(C).氨是氧化产物 (D).碳酸钠是氧化产物
二、按要求完成下列各题(共16分)
26、写出下列离子方程式:
(1)氢氧化钡溶液中通入足量的CO2气体
(2)二氧化硫气体通入到溴水中
(3)钠投入CuSO4溶液中:
(4)碳酸氢铵溶液中加入足量氢氧化钠并加热
27、写出下列热化学方程式:
(1)1克氢气在氧气中充分燃烧生成液态水,放出142.9kJ热量。
。
(2)在101 kPa时,4.0克硫粉在氧气中完全燃烧生成二氧化硫,放出37kJ热量,S燃烧的热化学方程式为 。
28、配平下列化学方程式,将化学计量数数填在括号内
| |
| |
| |
三、综合题(共16分)
29、(4分)①检验碳酸钠粉末中是否混有碳酸氢钠的方法是_____________________________,②除去下列物质中的杂质(括号内为杂质并写出离子方程式。)
NaHCO3溶液(Na2CO3),方法:_____________. 离子方程式:_____________________________.
30、有一瓶澄清溶液, 可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO![]() 、CO
、CO![]() 、NO
、NO![]() 、Cl-、I-现进行如下实验:
、Cl-、I-现进行如下实验:
(1)测知溶液显酸性
(2)取样加少量四氯化碳溶液和数滴新制氯水,振荡,CCl4层为紫红色
(3)另取样滴加稀NaOH溶液, 使溶液变为碱性, 此过程中及滴加后都无沉淀生成
(4)取少量上述碱性溶液, 加Na2CO3溶液出现白色沉淀
(5)将实验(3)中的碱性溶液加热, 有气体放出, 该气体能使湿润的红色石蕊试纸变蓝
试回答:
原溶液中肯定存在的离子
肯定不存在的离子是
不能确定是否存在的离子
2、某一无色透明溶液中可能存在H+ 、Ba2+、Mg2+ 、Cu2+ 、OH- 、HCO3- 、SO32-、NO3- 、Cl-中的一种或几种。已知该溶液能与Al反应放出H2 。
(1)若反应生成Al3+,则原溶液中一定存在或可能存在的离子有
_______________________
。
(2)若反应生成AlO2- ,则原溶液中一定存在或可能存在的离子有
______________________
。
*3.已知Cl2通入浓氨水中会发生如下反应:3Cl2+8NH3=6NH4Cl+N2,今有体积为1.12L,质量为3.335g的Cl2和N2的混合气体通过浓氨水后,体积变为0.672L[其中Cl2、N2各占50%(体积分数)]。(气体体积均在标准状况下测定)
(1)经计算,被氧化的氨的质量为___ _g。(不必写出计算过程)
(2)下面是三位学生从不同角度解这道题时所列的第一步算式,请判断他们所列未知数x分别表示什么量,并填写在表格内:
| 学生编号 | 所列第一步算式 | 未知数x表示的意义 |
| 甲 | (3-1)∶2=(1.12-0.672)/22.4∶x | |
| 乙 | 3∶(x-0.672/2)=1∶[0.672/2-(1.12-x)] | |
| 丙 | 71x+28(1-x)=3.335/1.12×22.4 |
19、在一定条件下,NO2跟NH3可以发生反应生成N2和H2O。现有NO2与NH3的混合物Imol,充分反应后所得产物中,经氧化得到的N2比经还原得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO2与NH3的物质的量可能各是多少。
四、计算题(共8分)
2.24克铁与100mL稀硝酸混合后充分反应,还原产生只有NO,并且铁、硝酸均无剩余。向反应后溶液中加入50mL0.2mol·L-1的KI溶液,恰好将溶液中的Fe3+全部还原。求原硝酸溶液的物质的量浓度。
(15分)PMAA是一种“智能型”有机高分子化合物,可应用于生物制药中大分子和小分子的分离。可以用下面的设计方案合成:
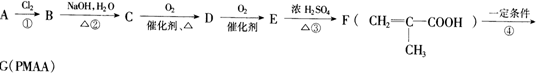
请填写下列空白:
(1)与出A、G的结构简式:A:_________________________,G:_______________________。
(2)①②③④反应中属于取代反应的有_________________________。
(3)写出C![]() D的化学方程式:___________________________。
D的化学方程式:___________________________。
(4)C与F在浓硫酸存在和加热条件下能够充分反应,此反应的反应类型是___________________,1 mol C最多能与___________________(填物质的量)F完全反应。
答案:
10.在120℃时,将24.8gCO2和H2O(g)的混合气体缓缓通过过量的过氧化钠固体,充分反应之后,固体质量增加了12g,请计算:
⑴产生氧气的质量
⑵原混合气体中CO2的质量
10. ⑴产生氧气的质量为12.8g
⑵原混合气体中CO2的质量17.6g