高三理科综合测试题(三)化学部分试题
以下数据可供解题时参考
相对原子量 H:1 C:12 O:16 S:32
第I卷(选择题,共48分)
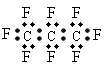 6.最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
6.最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
A、分子中三个碳原子可能处于同一直线上
B、全氟冰烷的电子式为:
C、相同压强下,沸点:C3F8<C3H8
D、全氟冰烷分子中既有极性键又有非极性键
7.设NA表示阿伏加德罗常数,下列叙述中正确的是
A.1mol铜与足量硫充分反应后转移的电子数为2NA
B.100mL 0.5mol·L-1乙酸溶液中含乙酸分子数为0.05NA
C.常温常压下,31g白磷分子中的共价键数为6NA
D.标准状况下,2.24L二氧化碳与二氧化硫的混合气体中所含分子数为0.1NA
8. 下列反应的离子方程式书写正确的是
A.溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
B.碳酸氢铵溶液与足量烧碱溶液反应:HCO3-+OH-=CO32-+H2O
C.铁屑溶于过量稀硝酸:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D.苯酚钠溶液中通入足量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
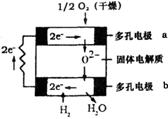 9.固体氧化物燃料电池是由美国西屋(Westinghouse)公司研
9.固体氧化物燃料电池是由美国西屋(Westinghouse)公司研
制开发的。它以固体氧化锆一氧化钇为电解质,这种固体
电解质在高温下允许氧离子(O2-)在其间通过。该电池的工
作原理如图所示,其中多孔电极a、b均不参与电极反应。
下列判断正确的是
A.有O2放电的a极为电池的负极
B.有H2放电的b极为电池的正极
C.a极对应的电极反应为:O2+2H2O+4e-=4OH-
D.该电池的总反应方程式为:2H2+O2=2H2O
10.将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中
c(Na+)>c(X-),则下列关系错误的是
A.c(OH-)<c(H+) B.c(HX)>c(X-)
C.c(X-)+c(HX)=2c(Na+) D.c(HX)+c(H+)=c(Na+)+c(OH-)
11.可逆反应mA(g)+nB(g) ![]() xC(g);
xC(g);
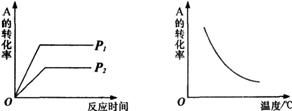 ΔH=akJ/mol,在不同温度及压强(P1
ΔH=akJ/mol,在不同温度及压强(P1
和P2)条件下反应物A的转化率的变
化情况如图所示。下列判断正确的是
A.a>0,m+n>x
B.a>0,m+n<x
C.a<0,m+n<x
D.a<0,m+n>x
![]() 12.吸进人体内的O2有2%转化为氧化性极强的活性氧副产物,如 等,这些活性氧能加速人体衰老,被称为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人体内的活性氧,在消除活性氧时,Na2Se03的作用是
12.吸进人体内的O2有2%转化为氧化性极强的活性氧副产物,如 等,这些活性氧能加速人体衰老,被称为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人体内的活性氧,在消除活性氧时,Na2Se03的作用是
A.还原剂 B.氧化剂
C.既是氧化剂,又是还原剂 D.以上均不是
13.已知热化学方程式2SO2(g)+
O2(g)![]() 2
SO3(g) △H= -Q kJ/mol(Q>0),则下列说法正确的是( )
2
SO3(g) △H= -Q kJ/mol(Q>0),则下列说法正确的是( )
A.2molSO2(g)和1mol O2(g)所具有的内能小于2 molSO3(g)所具有的内能
B.将2molSO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出QKJ的热量
C.升高温度,平衡向逆反应移动,上述热化学方程式中的Q值减小
D.如将一定量SO2(g)和 O2(g)置于某密闭容器中充分反应后放热QKJ,则此过程中有2molSO2(g)被氧化
第Ⅱ卷(非选择题,共60分)
![]() 26.(12分)m,n,x,y四种主族元素在周期表里的相对位置如图所示,已知它
26.(12分)m,n,x,y四种主族元素在周期表里的相对位置如图所示,已知它
们的原子序数总和为46,则:
(1)m与y所形成的化合物为 ,属于 分子(填极性分子或非性分子)。
(2)x的原子结构示意图为 。
(3)由n,y的氢化物相互作用所生成的物质的电子式为 。
27. (16分)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
⑴上述实验步骤中需要使用玻璃棒的是_______________(填实验序号),步骤①、③中研磨固体所用仪器的名称是___________________;
⑵步骤③中洗涤沉淀的操作是______________________________________________
__________________________________________________________。
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较
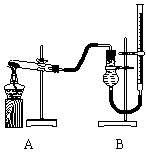 用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
| ④ | 1.2 g | 无其他物质 | |
| ⑤ | 1.2 g | CuO 0.5 g | |
| ⑥ | 1.2 g | MnO2 0.5 g |
回答下列问题:
⑶上述实验中的“待测数据”指_____________;
⑷本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管;
⑸若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,__________________________________________
____________________________________________________;
⑹为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a._______________________________,b.CuO的化学性质有没有改变。
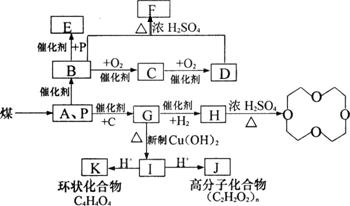
 28.(16分)煤的气化和液化是使煤变成清洁能源的有效途径。煤气化的主要反应是:水蒸气跟灼热的焦炭反应,生成A和P的混合气体,它是合成多种有机物的原料气。如图是合成某些物质的路线。
28.(16分)煤的气化和液化是使煤变成清洁能源的有效途径。煤气化的主要反应是:水蒸气跟灼热的焦炭反应,生成A和P的混合气体,它是合成多种有机物的原料气。如图是合成某些物质的路线。
![]()
![]() 其中,B为醇类中相对分子质量最小的有机物 ,E 为乙酸,且E、F、G互为同分异构体,且G能与新制Cu(OH)2反应;D、E是相邻的同系物。请回答下列问题:
其中,B为醇类中相对分子质量最小的有机物 ,E 为乙酸,且E、F、G互为同分异构体,且G能与新制Cu(OH)2反应;D、E是相邻的同系物。请回答下列问题:
![]() (1) 已知环氧乙烷(
)的结构可简写为 ,则
的分子式是
。
(1) 已知环氧乙烷(
)的结构可简写为 ,则
的分子式是
。
(2)写出下列物质的化学式A P
(3)写出下列物质的结构简式C G K
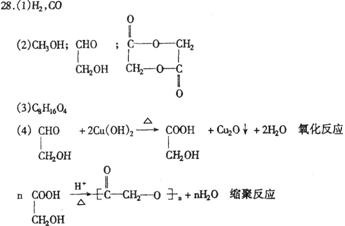
(4)写出下列反应的化学方程式并说明反应类型
G+Cu(OH)2→I 反应类型 。
![]() B D 反应类型
。
B D 反应类型
。
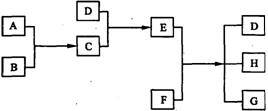 29. (16分)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
29. (16分)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
(1)D的化学式(分子式)是 ,E的化学式(分子式)是 。
(2)A和B反应生成C的化学方程式是 。
(3)E和F反应生成D、H和G的化学方程式是 。
高三理科综合测试题(三)化学部分
参考答案
6.D 7.D 8.A 9.D 10.A 11.D 12.A 13.D (每题6分)
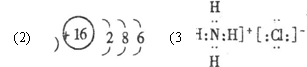
26.每格3’ (1)CCl4,非极性
![]() 27.⑴ ①②③
2’ 研钵 2’ ⑵沿玻璃棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2~3次 3’ ⑶时间2’ ⑷碱式 2’ ⑸取一根带火星的木条,伸入干燥管内,看木条是否复燃
3’ ⑹CuO的质量有没有改变 2’ 反应类型各1分,其余2分一格
27.⑴ ①②③
2’ 研钵 2’ ⑵沿玻璃棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2~3次 3’ ⑶时间2’ ⑷碱式 2’ ⑸取一根带火星的木条,伸入干燥管内,看木条是否复燃
3’ ⑹CuO的质量有没有改变 2’ 反应类型各1分,其余2分一格
 |
![]()
![]()
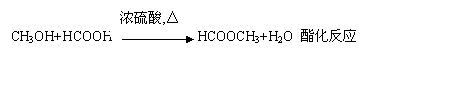
![]() 反应类型1分其余2分一格
反应类型1分其余2分一格
29.(1)NH3 4’ NH4Cl 4’
(2)H2+Cl2![]() 2HCl 4’
2HCl 4’
(3)2NH4Cl+Ca(OH)2![]() 2NH3↑+2H2O+CaCl2 4’
2NH3↑+2H2O+CaCl2 4’
高三理科综合测试题(三)化学部分答卷
班级 姓名 学号
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
26.(1) (2) (3)
27.(1)
(2)
(3) (4) (5)
(6)
28.(1) (2)
(3)
(4)
29.(1)
(2)
(3)