高三化学试测题
一、多选题(每小题3分,共30分)
1、碳所化合物是一种大气污染物,下列现象与碳氢化合物有关的是
A 臭氧空洞 B 光化学烟雾 C 酸雨 D 火山爆发
2、室温时下列溶液密度比纯水密度小的是
A 1mol·L-1HCl B 0.1mol·L-1 HNO3 C 0.01mol·L-1 H2SO4 D 25% 氨水
3、下列各组中,两种气体的分子数一定相等的是
A 温度相同、体积相同的O2和N2 B 质量相等、密度不等的N2和C2H4
C 体积相等、密度相等的CO和C2H4 D 压力相同、体积相同的N2和O2
4、下列说法正确的是
A 在化学反应中某元素由化合态变为游离态,该元素一定被还原了
B 失电子难的原子获得电子的能力一定强
C 电子层结构相同的各种离子,它的半径随核电荷数的增加而减小
D 最外层电子数较少的金属元素,一定比最外层电子数较它多的金属元素活泼性强
5、两个硫酸分子可以脱去一分子水生成焦硫酸(H2SO4)。已知硫酸的分子中有4个硫氧键,则焦硫酸分子中硫氧键的数目是
A 4 B 6 C 7 D 8
6、 下列各组物质中,两者互为同分异构的是
A NH4CNO与CO(NH2)2 B CuSO4·3H2O与CuSO4·5H2O
C [Cr(H2O)4Cl2]Cl·2H2O与[Cr(H2O)5Cl]Cl2·H2O D H2O与D2O(氨水)
7、某容积可变的密闭容器中放入一定量的A和B的混合气体,在一定条件下发生反应:A(气)+2B(气)≒2C(气)。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时C气体的体积占40%,则下列推断正确的是
A 原混合气体的体积为1.1V B 原混合气体体积为1.2V
C 反应达到平衡时,气体A消耗了0.2V D 反应达到平衡时,气体B消耗了0.2V
8、下列说法正确的是
A 相同温度下,1 mol·L-1氨水溶液与0.5 mol·L-1氨水溶液中,[OH-]之比是2:1
B 0.1 mol·L-1 NH4Cl溶液中的[NH![]() ]=[Cl-]
]=[Cl-]
C 向0.1 mol·L-1NaNO3 溶液中滴加稀盐酸,使溶液pH=5,此时混合液中[Na+]=[Cl-]
D 向醋酸钠溶液中加入适量醋酸,使 混合液的pH=7,此时混合液中[Na+]=[CH3COO-]
9、制备卤磷酸钙萤光粉所用的高纯氯化钙中混有镁杂质,除去的方法是把氯化扌的水溶液加热到90~95℃,在不断搅拌下加入适当的沉淀剂,使镁生成沉淀过滤除去。此沉定最好选用
A 氢氧化钙乳浆 B 碳酸钠溶液 C 碳酸氢钠溶液 D 氢氧化钠溶液
10、下列溶液,一定呈中性的是
A 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
B [H+]=1×10-7mol·L-1 的溶液 C pH=14-pOH 的溶液 D pH=pOH 的溶液
二、单选题(每小题4分,共20分)
11、相同质量的四份铜片,分别置于足量的下列酸中,所得到的气体的物质的量最多的是
A 浓硫酸 B 稀硫酸 C 浓硝酸 D 稀硝酸
12、甲、乙、丙三种不同浓度的稀H2SO4,分别跟等物质的量的Al、KHCO3和K2CO3刚好反应完全,所耗去甲、乙、丙三种酸的体积比为1:2:3,则甲、乙、丙三种酸物质的量之比应是
A 1:1:1 B 3:1:2 C 6:3:2 D 18:3:4
13、某烃室温时为气态,完全燃烧后,生成的H2O和CO2的物质的量之比为3:4。该不饱和烃的链状同分异构体的数目应是
A 2 B 3 C 4 D 5
14、已知甲醛(HCHO)分子中的4个原子共平面的。下列分子中所有原子不可能同时存在于同一个平面上的是
![]()
![]()
A 苯乙烯 B 苯甲酸
![]()

C 苯甲醛 D 苯乙酮
15、下列溶液经反应后,溶液内含有0.50 mol NaHCO3和0.50 mol Na2CO3的是
A 0.50L 1.00 mol·L-1NaHCO3加0.50L 0.50 mol·L-1NaOH
B 0.50L 0.75 mol·L-1 Na2CO3加0.50L 0.50 mol·L-1 HCl
C 0.50L 1.00 mol·L-1 NaHCO3 加0.50L 0.25 mol·L-1 NaOH
D 1.00L 1.00 mol·L-1 Na2CO3 加1.00L 0.50 mol·L-1 HCl
三、(本大题共14分)
16、为了测定某烷烃样品(丁烷,并含少量丙烷等气态烃)的平均分子量,设计了下面的实验:①取一个配有合适胶塞的洁净、干燥的锥形瓶,准确称量,得到质量m1 ②往锥形瓶中通入干燥的该烷烃样品,塞好胶塞,准确称量;重复操作,直到前后两次称量结果基本相同,得到质量m2 ③往锥形瓶内加满水,塞好胶塞,称量得到质量m3 已知实验时的温度T(K),压强P(Kpa),水的密度![]() (g·L-1)空气的平均分子量29.0,密度
(g·L-1)空气的平均分子量29.0,密度![]() (g·L-1),回答下面问题:
(g·L-1),回答下面问题:
⑴本实验的原理是(具体说明)
⑵步骤②中为什么要重复操作,直到前后两次称量结果基本相同?
⑶具体说明本实验中怎样做到每次测量都是在相同条件下进行的?
⑷本实验中收集气体样品的操作,可选用的方法是(填图中标号)

⑸锥形瓶内空气的质量(![]() )是
(列出算式)。
)是
(列出算式)。
⑹瓶中样品的质量(![]() )是
(列出算式)。
)是
(列出算式)。
⑺由实验测得该烷烃的平均分子量是 (列出算式)。
四、(本大题共3个小题,共20分)
17、(6分)设X、Y、Z代表3种元素。已知:①X+和Y-两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子核内质子数少9个;③Y和Z两元素可以形成四核42个电子的负一价阴离子。据此,请填空:
⑴Y元素是 ,Z元素是 。
⑵由X、Y、Z三元素所形成的含68个电子的盐类化合物之分子式(即化学式)是
18、(6分)下表数据是在某高温度下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
| 反应时间 t/h | 1 | 4 | 9 | 16 | 25 |
| MgO层厚Y/nm NiO层厚Y′/nm | 0.05a b | 0.20a 2b | 0.45a 3b | 0.80a 4b | 1.25a 5b |
*注:a和b均为与温度有关的常数
请填空回答:
⑴金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是
。
⑵金属氧化膜的膜厚Y跟时间t所呈现的关系是(填直线、抛物线、对数或双曲线等类型):MgO氧化膜厚Y属 型,NiO氧化膜厚Y′属 型。
⑶Mg与Ni比较,哪一种金属具有良好的耐氧化腐蚀性: ,其理由是:
。
19、(8分)
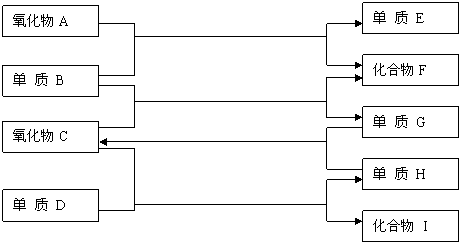
高温
反应①
![]()
高温
反应②
燃烧
反应③
高温
反应④
如上图,已知:
①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应。
据此,请填空:
⑴化合物F是 。⑵化合物I 是 。
⑶反应③的化学方程式是
⑷反应④的化学方程式是
五、(本大题共3小题,共24分)
20、(9分)某烃A分子量是156,在CCl4溶液中跟Br2不起反应。但是在光照下,Br2可以跟A起取代反应。取代产物的分子量是235的只有两种:产量较多的一种是B,产量较少的一种C。另外,还可得到分子量是314的产物多种。
⑴请写出A、B、C的结构简式。
⑵分子量是314的有多少种?试写出它们的结构简式。
21、(6分)氰化钾(KCN)的氰基(CN)可以取代卤代烃的卤素(X)生成腈(R-CN)。腈可以经酸性水解成为羧酸(RCOOH);腈也可以被催化加氢成为胺(RCH2NH2)。
请自选一种卤代烃,由它和任意无机试剂合成制取尼龙66所需要的两种原料:己二酸
HCOOC(CH2)4COOH和H2NCH2(XH2)4CH2NH2 。写出各步反应方程式(需配平)。
22、(9分)已知某化合物甲,分子中只含C、H、O三种元素,其C、H的质量分数合计为78.4%。又已知,甲分子中有一个碳原子,它的4个价键分别连接在4个不同的原子(或原子团)上,如下图所示:

A、B、D、E为互不相同的原子或原子团。请⑴建议甲的分子
⑵写出甲的结构简式,并以系统法命名之。
![]() 六、(本大题共12分)
六、(本大题共12分)
23、⑴邻苯二甲酸氢钾( 分子量204.2)可以用于标定NaOH溶液的浓度反应如下:KHC8H4O4 + NaOH = KnaC8H4O4 + H2O。准确称取KHC8H4O4晶体0.5105g,溶于水后加入酚酞指示剂,用NaOH溶液滴定至溶液呈淡红色,消耗NaOH溶液的浓度(结果保留四位有效数字)。
⑵测定食醋的总酸度。食醋中除醋酸(CH3COOH)外,还含有少量其它有机酸。食醋的总酸度以每1000mL食醋中含醋酸(其它酸也折算作醋酸)的质量(g)表示,通常写作CH3COOH%。用移液管移取市售食醋50.00mL,置于250mL容量瓶中,用水稀释至刻度。再从中移取25.00mL,用上小题 已知浓度的 NaOH溶液滴定,消耗碱液体积为V(mL), 写出CH3COOH%的计算式。
⑶已知0.1mol·L-1 邻苯二甲酸溶液的pH大于1,取等体积的邻苯二甲酸溶液和某KOH溶液混合,测得混合液的pH等于7,则碱与酸的浓度比值(X)为 (选填下列选项编号)。
A x>2 B x=2 C 2>x>1 D x=1 E1>x>1/2 F x=1/2
化学试测题答案
一、1.B 2. D 3.BC 4.C 5.D 6.AC 7.BC 8.CD 9.A 10.D
二、11.C 12.D 13.C 14.D 15.D
三、16、⑴根据阿伏加德罗定律,同温、同压下,两种同体积的不同气体的质量之比等于它们的相对分子量之比。(2分)
⑵为了保证瓶内的空气已完全被排出,并充满了样品气。 (2分)
⑶第一次称量前,锥形瓶塞紧胶塞后,在瓶口处的胶塞上做一记号,以后每次测量,胶塞塞入瓶口的位置都以此为准。 (2分)
⑷ D (2分)
⑸ ![]() (2分)
(2分)
⑹ m2-m1+m空气 (2分)
⑺ 29.0×![]() (2分)
(2分)
四、17、⑴Cl(氯),O(氧) ⑵ KClO3 (每空2分,共6分)
18、⑴反应速率可以用反应物的消耗速率,也可以用产物的生成速率。 ⑵ 直线,抛物线⑶Ni,它的腐蚀速率随时间的增长比镁的要慢。(前四空每空1分,最后一空2分,共6分)
19、⑴CO(一氧化碳) ⑵HF(氟化氢) ⑶ 2H2+O2=2H2O ⑷ 2F2+2H2O=4HF+O2
(每空2分,共8分)
 五、20、⑴
五、20、⑴
(每 个1分,共3分)

⑵
(每个1分,共6分,
写重复的倒扣分)
22、⑴ C4H10O (4分) ⑵ CH3CHOHCH2CH3 2-丁醇 (3分)
六、23、⑴ c(NaOH)=0.125molL-1 (3分) ⑵ CH3COOH%=150V% (4分)
⑶ C (5分)