高三化学试卷
(高中第一册第1、2章)
本卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共150分。考试用时120分钟。
第Ⅰ卷(选择题 共72分)
可能用到的相对原子质量: H—1 Na—23 Mg—24 Al—27 Fe—56 K—39 Cu—64 Ag—108 Cl—35.5 Br—80 Li—7 C—12 O—16 S—32
一、 选择题(本题包括8小题,每题4分,共32分。每小题只有一个选项符合题意。)
1.苹果汁是人们喜欢的饮料,由于饮料中含有Fe2+,现榨的苹果汁在空气中会由浅绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这现象发生。这说明维生素C具有 ( )
A.氧化性 B.还原性 C.碱性 D.酸性
2.已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:(1)CuSO4溶液与Na2CO3溶液混合主要:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑ 次要:Cu2++CO32-=CuCO3↓ (2)CuSO4溶液与Na2S溶液混合主要:Cu2++S2-=CuS↓ 次要:Cu2++S2-+2H2O= Cu(OH)2↓+H2S↑ 则下列物质的溶解度大小的比较正确的是 ( )
A.Cu(OH)2 〉 CuCO3 〉 CuS B. CuS 〉 Cu(OH)2 〉 CuCO3
C. Cu(OH)2 〈 CuCO3 〈 CuS D. CuS 〈 Cu(OH)2 〈 CuCO3
3.已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是 ( )
A.Fe3+ B. MnO4- C. Cl2 D. HNO2
4.臭氧可使湿润的淀粉碘化钾试纸变蓝,化学方程式为:KI+O3+H2O→KOH+I2+O2(未配平)
下列叙述正确的是 ( )
A.该反应的还原产物是I2 B.每生成1molI2,转移电子2mol
C.反应中氧化剂与还原剂物质的量之比1:1 D.在反应中H2O被氧化成O2
5.已知在25℃,101KPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40KJ热量。表示上述反应的热化学方程式正确的是 ( )
A. C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g) △H=-48.4KJ.mol-1
B. C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) △H=-5518KJ.mol-1
C. C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) △H=+5518KJ.mol-1
D.C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) △H=-48.4KJ.mol-1
6.某溶液中含有HCO3-,SO32-,CO32-,CH3COO-等4种阴离子,向其中加入足量的过氧化钠固体后,溶液中离子浓度基本保持不变的是 ( )
A.CH3COO- B. SO32- C. CO32- D. HCO3-
7.下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是 ( )
A.盐酸 水煤气 醋酸 干冰 B.冰醋酸 福尔马林 纯碱 液氨
C.单甘油酯 乙醇 苛性钠 石灰石 D.胆矾 漂白粉 氯化钠 氯气
8.实验室保存少量药品:①白磷;②金属钠;③红磷;④液溴;⑤苯。其中需要水封的是( )
A.只有② B. ①③ C. ①④ D. ③⑤
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确选项包括两个选项,只选一个且正确的 给2分,选两个且正确的给4分,但只要选错一个,该小题为0分。)
9.下列各物质微粒,所有原子都满足最外层为8电子结构的是 ( )
A. H2O B.Na2O2 C.NaOH D.Na2O
10.有以下四种判断:①两种弱酸相互反应生成两种强酸;②两种弱酸盐相互反应生成两种强酸盐; ③两种酸溶液相互反应后溶液的酸性的酸性减弱;④一种酸和一种盐溶液反应后溶液的酸性增强。其中有具体例证的是 ( )
A.①② B.①③④ C.②③④ D.①②③④
11.若溶液中由水电离产生的C(OH-)=1╳10-14mol.L-1,满足此条件的溶液中一定可以大量共存的离子是 ( )
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3- C.K+ Na+ Cl- AlO2- D.K+ NH4+ SO42- NO3-
12.对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:
① 加热时放出的气体可以使品红溶液褪色
② 加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝
③ 加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在溶液中是否存在的是 ( )
A.Br- B.SO42- C.H2SO3 D. NH4+
13.能正确表示下列化学反应的离子方程式是 ( )
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B.金属铝溶于盐酸中:Al+2H+=Al3++H2↑
C.硫化钠溶于水中:S2-+H2O=H2S↑+2OH-
D.碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑
14.已知碳酸中C(CO32-)比偏铝酸中C(AlO2-)大得多,则下列说法中正确的是 ( )
A. 通入适量CO2于AlO2-溶液中有CO32-生成
B. 含CO32-的溶液容易使Al(OH)3溶解变成AlO2-
C. HCO3-只能与Al3+反应而不能与AlO2-反应
D. NH4+、AlO2-、HCO3-能大量共存与同一溶液中
15.只用水不能区别的一组物质是 ( )
A.苯,乙酸钠,四氯化碳 B.硝酸铵,烧碱,食盐
C.熟石灰,生石灰,石灰石 D.氯化铜,氯化钙,氯化镁
16.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,正确的叙述是 ( )
A.溶液仍为紫色 B.最后溶液变蓝色 C.最后溶液褪色 D.溶液有气泡产生
17.在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和PH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是 ( )
A.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
B.甲烧杯中的酸过量
C.两烧杯中参加反应的锌等量
D.反应开始后乙烧杯中的C(H+)始终比甲烧杯中C(H+)小
18.室温下,两种一元酸的钠盐NaX和NaY,已知往NaX溶液中通CO2只能生成HX和NaHCO3,往NaY溶液中通CO2能生成HY和Na2CO3,下列说法正确的是 ( )
A.酸性HX 〉HY B.结合质子的能力Y- 〉CO32- 〉X- 〉HCO3-
C.溶液的碱性NaX 〉Na2CO3 〉NaY 〉NaHCO3 D.HX和HY酸性相同,都比H2CO3弱
第Ⅱ卷(非选择题,共78分)
三.(本题包括2小题)
19.草酸晶体的组成可表示为H2C2O4·xH2O,为测定x值,进行下述实验:①称取w g草酸晶体配成100.0mL水溶液;②取25.00mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为a mol/LKMnO4溶液滴定,滴定时发生的化学方程式为
2 KMnO4 + 5 H2C2O4 + 3 H2SO4== K2SO4 + 10 CO2↑+ 2 MnSO4 + 8H2O.
回答下列问题:
(1)实验①中,为配置准确物质的量浓度的草酸溶液,所需要用到的仪器是 .
(2)实验②中, 滴定时KMnO4溶液应装在棕色的 式滴定管中.
(3) 若滴定时KMnO4溶液因久置而部分变质其浓度偏低,则实验结果所测定的x值将 .
(4) 滴定过程中,当KMnO4溶液与草酸反应后, KMnO4溶液的 色将 色.
(5) 若滴定终点时,共用去a mol/L KMnO4溶液V mL,则实验测定得所配草酸溶液的物质的量浓度为 ;由此计算出草酸晶体中的x值是 .
20.有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带灰烬的木条插入试管C中,木条复燃。
请回答下列问题:
(1) 第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:___________________.
(2) 请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。_______________ .
(3) 第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
![]()
上述方案是否合理?______。请简要说明两点理由:①;_________②_________。
四.(本题包括3题)
21.某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3―、SO42―、HCO3―、Cl―等,取该溶液进行如下实验:①将溶液滴在蓝色石蕊试纸上,试纸显红色; ②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变成红棕色;③取溶液少许,加入氨水有沉淀生成,继续加入氨水,沉淀不消失;④取溶液少许,滴入氯化钡产生白色沉淀;⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量稀硝酸,沉淀不消失.请回答下列问题:
(1)根据上述判断原溶液中肯定存在的离子是 ,肯定不存在的离子是 .
(2)写出②③④三个实验有关的离子方程式: ② ;③ ;④ ;
22.由A、B两种常见化合物组成的混合物,其焰色反应均呈黄色,其相互转化关系如图所示.(其他物质均已略去).根据以上关系回答下列问题:
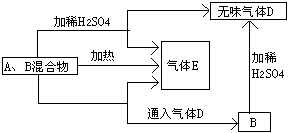
(1)写出A、B、E、D的化学式A B E D
(2)写出混合物组分分别加水的化学方程式 _________、
(3)加热后,若只得到一种化合物,则A与B的物质的量之比的最大值为
23.根据下列框图关系填空.已知反应①、③是工业生产中的重要反应,D、E常温下为气体,X常温下为无色液体, H与E相对分子质量之间的关系为:Mr(H) ― Mr(E) = 34,又知C的焰色反应呈黄色.
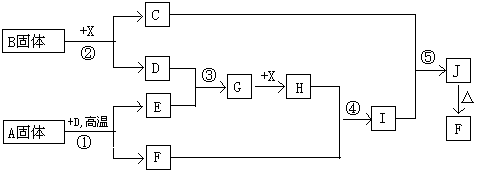
(1) 化合物B中所包含的化学键有:
(2) 反应④的离子方程式: ___ ;反应⑤的化学方程式:
(3) 已知每生成16g E,放出106.5 kJ 热量,则反应①的热化学方程式为:
五.(本题包括2小题)
24.取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL1.00mol/L过量盐酸反应,生成2.016LCO2(标准状况),然后加入500mL0.100mol/LBa(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL1.00mol/L盐酸恰好完全中和.计算混合物中各物质的质量.
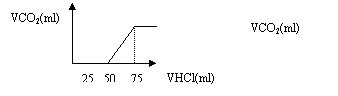
 25.有50mlNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10ml,将其稀释至100ml,并向此稀释后的溶液中逐滴加入0.1mol.L-1的HCl溶液,产生的CO2气体体积(标准状况)与所加入盐酸的体积之间的关系如图所示:
25.有50mlNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10ml,将其稀释至100ml,并向此稀释后的溶液中逐滴加入0.1mol.L-1的HCl溶液,产生的CO2气体体积(标准状况)与所加入盐酸的体积之间的关系如图所示:
 | |||
| |||
则:试分析通过计算回答NaOH在吸收CO2气体后,在甲、乙两种情况下,所得溶液中存在的溶质是什么?其物质的量之比是多少?且在两种情况下吸收的CO2气体体积(标准状况)各是多少?原NaOH溶液的物质的量浓度是多少?
答:(甲)溶质为_________________,其物质的量之比为_________,原溶液在标准状况下吸收CO2气体的体积为_________________;
(乙)溶质为_________________________,其物质的量之比为___________,原溶液在标准状况下吸收CO2气体的体积为_______________;原NaOH溶液物质的量浓度为_______________。
高三化学答题卷
班级 姓名
第Ⅰ卷(选择题 共72分)
一、二选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(非选择题,共78分)
三、(本题包括2小题)
19、(1)
(2)
(3)
(4) 、
(5) 、
20、(1)
(2)
(3)
① ②
四、(本题包括3题)
21、(1) 、
(2)
22、(1) 、 、 、
(2)
(3) ]
23、(1)
(2)
(3)
五、(本题包括2小题)
24、
25、