高三化学试题练习
1.下列分子中所有原子都满足最外层为8电子结构的是
A.BF3 B.H2O C.SiCl4 D.PCl5
![]() 2.对于2 SO2 (g)
+ O2 (g) 2 SO3 (g) ;ΔH< 0,工业生产采用的下列措施中,不是从提高化学反应速率或SO2转化率的因素考虑的为
2.对于2 SO2 (g)
+ O2 (g) 2 SO3 (g) ;ΔH< 0,工业生产采用的下列措施中,不是从提高化学反应速率或SO2转化率的因素考虑的为
A.使用V2O5做催化剂 B.接触室中不使用很高的温度
C.用过量的空气跟SO2反应 D.接触氧化在常压下进行
3.t℃时,将一定量A的不饱和溶液均分为三份,分别加热蒸发,然后冷却至t ℃,已知三份溶液分别蒸发水的质量为10g、20g、30g,析出A晶体(不含结晶水)的质量依次为ag、bg、cg,则a、b、c三者的关系为
A.c = a + b B.c = 2 b-a C.c = a + 2 b D.c = 2 a-b
4.常温时,将V1 mL c1 mol·L-1的醋酸滴加到V2 mL c2 mol·L-1的烧碱溶液中,下列结论正确的是
A.若V1 = V2,且混合溶液pH < 7,则有c1 < c2
B.若V1 = V2,c1 = c2,则混合溶液中c (Na+) = c (CH3COO-)
C.若混合溶液的pH = 7,则有c1 V1 >c2 V2
D.若混合溶液的pH = 7,则混合溶液中c (Na+) > c (CH3COO-)
5.下列说法中正确的是
A.最外层有2个电子的原子都是金属原子
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
D.最外层有5个电子的原子都是非金属原子
6.在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1mol Cr3+反应所需PbO2的物质的量为
A.3.0 mol B.1.5 mol C.1.0 mol D.0.75 mol
7.下列反应的离子方程式正确的是
A.铝片跟氢氧化钠溶液反应:Al + 2 OH- = AlO2- + H2↑
B.硫酸镁溶液跟氢氧化钡溶液反应:SO42- + Ba2+ = BaSO4↓
C.碳酸钙跟醋酸反应:CaCO3+2CH3COOH = Ca2++ 2CH3COO-+H2O +CO2↑
D.铜片跟稀硝酸反应:Cu + NO3- + 4H+ = Cu2+ + NO↑+2 H2O
8.法国化学家伊夫·肖万获2005年诺贝尔化学奖。他发现了烯烃里的碳-碳双键会被拆散、重组,形成新分子,这种过程被命名为烯烃复分解反应 。烯烃复分解反应可形象地描述为交换舞伴。(如图所示)
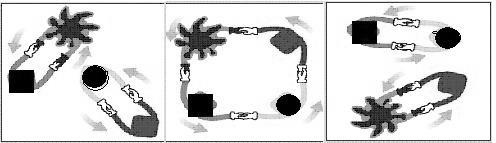
烯烃复分解反应中的催化剂是金属卡宾(如CH2==M),金属卡宾与烯烃分子相遇后,两
对舞伴会暂时组合起来,手拉手跳起四人舞蹈。随后它们“交换舞伴”,组合成两个新分子,其中一个是新的烯烃分子,另一个是金属原子和它的新舞伴。后者会继续寻找下一个烯烃分子,再次“交换舞伴”。把C6H5CH2CH==CH2与CH2==M在一定条件下混合反应,下列产物不可能存在的是
A. C6H5CH2 CH2 C6H5 B. CH2= CH2
C. C6H5CH2CH==M D. C6H5CH2CH==CH CH2 C6H5
|
![]() ①A + B
M + D +
E; ② M +
E → A +
F + B
①A + B
M + D +
E; ② M +
E → A +
F + B
请针对以下两种不同情况回答:
(1)若A是一种钠盐,反应①是化学工业上制取单质E和化合物M的重要方法。则A的电子式为 ;已知单质D的气体在氧气中燃烧生成0.5 mol液态产物时,放出热量a kJ,反应的热化学方程式是_________________________;反应②的离子方程式为 。
(2)若A是一种含氧酸盐,可用于实验室中检验水的存在。1个A的酸根离子中共含有50个电子,其中含有一种元素X,X的原子最外层电子数是电子层数的2倍,则 X在元素周期表中的位置是第 周期 族。X单质的熔点是112.8℃ , 则X单质的晶体类型属于 晶体。X与碳单质在一定条件下可以生成CX2的化合物,其分子结构类似于CO2,则CX2属于(填“极性”或“非极性”) 分子。反应②的化学方程式为______________________________。
10.(12分)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
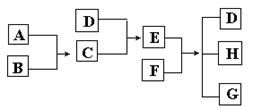 |
⑴ D的化学式(分子式)是_____________,E的化学式(分子式)是_____________。
⑵ A和B反应生成C的化学方程式是______________________________。
⑶ E和F反应生成D、H和G的化学方程式是____________________________。
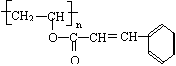 11.(15分)感光性高分子又称为“光敏性高分子”,是一种在彩电荧光屏及大规模集成电路制造中应用较广的新型高分子材料。其结构简式为:
11.(15分)感光性高分子又称为“光敏性高分子”,是一种在彩电荧光屏及大规模集成电路制造中应用较广的新型高分子材料。其结构简式为:
(1)在一定条件下,该高聚物可发生的反应有 (填代号)
① 加成反应 ② 氧化反应 ③ 消去反应
④ 酯化反应 ⑤ 取代反应
(2)该高聚物在催化剂的作用下,水解后的产物中有一种相对分子质量较小的R,其分子式为 。
(3)写出R与乙醇在浓硫酸作用下加热反应的化学方程式:________________________
,该反应类型是________________。
(4)![]() R的同分异构体有多种,其中含有苯环、
和
,且苯环上有两个对位取代基的结构简式是
R的同分异构体有多种,其中含有苯环、
和
,且苯环上有两个对位取代基的结构简式是
。
12.(16分)实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程
式为: 。 试回答:
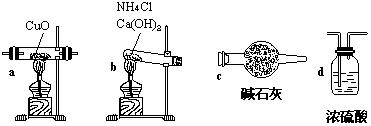 |
(1) 如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
① 仪器连接的顺序(用字母编号表示,仪器可重复使用) ;d中浓硫酸的作用是 、 _____;实验完毕时观察到a中的现象是 ___________________。
② 列出计算Cu的相对原子质量的表达式 ;
③ 下列情况将使测定结果偏大的是 .(以下选择填空不限一个正确答案,均用字母编号填写)
(a)CuO未全部还原为Cu (b)CuO受潮 (c)CuO中混有Cu
(2)如果仍采用上述仪器装置,其他方案可选用测定的物理量有 __________。
(a)m(Cu)和m(CuO) (b) m(N2)和m(H2O)
(c) m(Cu)和m(H2O) (d) m(NH3)和m(CuO)
1.C 2.D 3.B 4.C 5.C 6.B 7.C 8.A
‥
9.(1)Na+ [ ∶Cl∶]¯ (2分) 2 H2(g)+ O2(g)= 2H2O(l);△H = -4a kJ/mol
‥
Cl2 + 2 OH¯ = Cl¯ + ClO¯ + H2O (3分) (3分)
(2) 三 ⅥA (各1分) 分子 (2分) 非极性 (2分)
∆
Cu + 2 H2SO4((浓) ==== CuSO4 + 2 SO2↑ + 2 H2O (3分)
|
(2) H2 + Cl2 = 2 HCl
(3) ∆
2 NH4Cl + Ca(OH)2 ==== 2 NH3↑ + 2 H2O + CaCl2 (每空各3分)
11.(1) ① ② ⑤ (3分)
(2)C9H8O2 (3分)
![]() (3)
(3)
酯化反应 (2分) (3分)
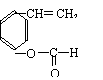 |
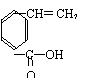 (4)
(4)
(2分) 、 (2分)
12. .(1) ①b c a c d (3分) 吸收未反应的氨 防止空气中水分进入装置(3分)
![]()
固体由黑色转变
(3分)
(3分) (2分)
(2) a、c (2分)