高三化学下学期期初考试试题
(满分:150分;考试时间:120分钟)
相对原子质量:
H 1 C 12 N 14 O 16 Na 23 P 31
S 32 Cl 35.5 K 39 Fe 56 Ag 108 Br 80
第I卷(选择题 共74分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.为了提高硫酸工业的综合经济效益,下列做法正确的是 ( )
①对硫酸工业生产中产生的废气、废液、废渣实行综合利用 ②充分利用硫酸工业中的废热 ③不把硫酸工厂建在人口稠密的居民区和环保要求高的地区
A.只有① B.只有② C.只有③ D.①②③全部正确
2.下列物质属于非电解质的是 ( )
A.CO2 B.H2O C.Cl2 D.CH3COOH
3.下列晶体,每个原子都被相邻的4个原子包围以共价键相结合形成正四面体结构并向空间发展形成网状结构的是 ( )
A.甲烷晶体 B.晶体硅 C.石墨 D.水晶
4.下列叙述正确的是 ( )
A.离子晶体中只存在离子键 B.原子晶体中只存在非极性共价键
C.冰是水分子间通过氢键作用而规则排列形成的分子晶体
D.熔融态氯化钠和金属铜的导电原理相同
5. 有关Fe(OH)3胶体的说法不正确的是 ( )
A.有丁达尔现象 B.胶体粒子的直径小于1nm
C.是红褐色的透明液体 D.胶体粒子在电场作用下向阴极移动
6.在pH=1的溶液中,能够大量共存的是 ( )
A.Na+ K+ S2- Cl-
B.Al3+ Mg2+ SO![]() Cl-
Cl-
C.K+ Na+ Al3+ HCO![]() D.K+ AlO
D.K+ AlO![]() NO
NO![]() SO
SO![]()
7.下列反应的离子方程式错误的是 ( )
A.向碳酸氢钙溶液中加入过量氢氧化钠
Ca2++2 HCO![]() +2OH- = CaCO3↓+2H2O+CO
+2OH- = CaCO3↓+2H2O+CO![]()
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH![]() +HCO
+HCO![]() = BaCO3↓+NH3·H2O+H2O
= BaCO3↓+NH3·H2O+H2O
C.氢氧化铝与足量盐酸反应 Al(OH)3+3H+ = Al3++3H2O
D.向氢氧化钠溶液中通入过量CO2 CO2+2OH- = CO![]() +H2O
+H2O
8.常温下,pH=3的二元弱酸H2R溶液与a L pH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合溶液的叙述正确的是
A、c(R2-)>c(Na+)>c(H+)=c(OH-) B、2c(R2-)+c(HR-)=c(Na+)
C、c(R2-)+c(OH-)=c(Na+)+c(H+) D、混合液的体积为2a L
二、选择题(本题包括10小题,第9—16题每小题4分,第17—18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为。分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.下列反应属于氧化还原反应的是 ( )
①Na2O2+ 2HCl = 2NaCl + H2O2 ②2Na2O2+ 2H2O= 4NaOH+ O2↑
③Cl2 + H2O = HCl +HClO ④ICl + H2O = HCl +HIO
A.①④ B.①③ C.②③ D.只有②
10.某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42—的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为( )
A.11.2 g B.16.8 g C.19.6 g D.22.4 g
11.下列变化或数据与氢键无关的是 ( )
A.甲酸蒸气的密度在373K时为1.335g·L-1,在293K时为2.5 g·L-1
B. 氨分子与水分子形成一水合氨
C. 乙醇在水中以任意比溶解 D. SbH3的沸点比PH3高
12.运用元素周期律分析下面的推断,其中错误的是:①铍(Be)的氧化物的水化物可能具有两性,②铊(Tl)既能与盐酸作用产生氢气,又有跟NaOH溶液反应放出氢气,Tl(NO3)3溶液的酸性 很强,③砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于稀酸,④锂(Li)在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱,⑤硫酸锶(SrSO4)是难溶于水的白色固体,⑥硒化氢(H2Se)是无色,有毒,比H2S稳定的气体
A.①②③④ B.②④⑥ C.①③⑤ D.②④⑤
13.下列各组物质的颜色变化,可用平衡移动原理解释的是 ( )
A.氯化铁溶液中加入少量碘化钾晶体,振荡后颜色变深
B.氯化铁溶液加热后颜色变深
C.氯化铁溶液加入铁粉振荡后颜色变浅
D.对NH3与过量O2的催化氧化反应来说,降低温度.
14.NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.铁、铜和稀硫酸构成原电池,当转移NA个电子时,产生的气体体积为11.2L
B.通常状况下将0.5molHI气体和0.5molCl2混合后,气体的分子数为NA
C.46g 二氧化氮和46g四氧化二氮含有的原子数均为3NA
D.53gNa2CO3固体含有的离子数为1.5NA
 15.维生素E在有“生命奇迹丸”的美称,它是一种脂溶性维生素,对抗衰老等有特殊作用,经研究发现维生素E有α、β、γ、δ四种类型,其结构简式如下:
15.维生素E在有“生命奇迹丸”的美称,它是一种脂溶性维生素,对抗衰老等有特殊作用,经研究发现维生素E有α、β、γ、δ四种类型,其结构简式如下:
其中R为—CH2CH2CH2[CH(CH3)CH2CH2]2CH(CH3)2。上述互为同分异构体的是( )
A.α与β B.β与γ C.γ与δ D.α与γ
16.如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
 A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液变浑浊
C.若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀后沉淀又溶解
D.实验仪器D可以起到防止溶液倒吸的作用
17.两种有机物以一定比例混合,在一定条件下在aLO2(足量)中燃烧,充分反应后恢复到原状态,再通过足量Na2O2层,得到气体仍为aL,下列混合物符合此条件的是 ( )
A.CH4 C2H4 B.CH3OH CH3COOH
C.C2H6 HCHO D.HCOOH CH3COOCH3
18.已知400℃和1标准大气压时的气体摩尔体积为55.20L/mol,在该条件下1mol气体发生如下反应并达到平衡:2X(g) mY(g) + Z(g) ,测得混合气体中X的体积分数为0.5880,混合气体的总质量为46.00克,混合气体的密度为0.72g/L 。则平衡混合气体的平均相对分子质量为( )
![]() A.58.80 B.46.00 C.39.72 D.16.13
A.58.80 B.46.00 C.39.72 D.16.13
第Ⅱ卷 (非选择题 共76分)
三、(本题包括2小题,共22分)
19.有常用玻璃仪器组成的下列五种实验装置(根据需要可在其中加入液体或固体)
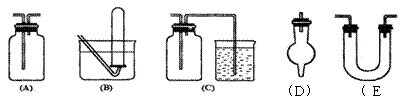
(1)能用做干燥二氧化硫气体的装置有________(填代号,下同)
(2)既能用于收集氯气又能用于收集一氧化氮气体的装置有________
(3)在氯气和铁反应实验中,能添加在制气和化合反应装置之间以除去氯气中氯化氢
等杂质气体的装置有________
(4)若用C装置做二氧化硫与烧杯中氢氧化钠溶液反应实验,则其中广口瓶的作用是________.
20.向溴水中加入足量的乙醛溶液,可以看到溴水褪色,对产生该现象的原因有如下三种猜想:①溴水与乙醛发生取代反应;②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应;③由于乙醛具有还原性,溴水将乙醛氧化为乙酸。为探究哪种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br—离子的物质的量。
⑴方案一是否可行 (填“是”或“否”),理由是 。
⑵假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br—)= mol,则说明溴水与乙醛发生取代反应;若测得反应后n(Br—)= mol,则说明溴水与乙醛发生加成反应;若测得反应后n(Br—)= mol,则说明溴水将乙醛氧化为乙酸。
⑶按物质的量之比为1:5配制1000mLKBrO3—KBr溶液,该溶液在酸性条件下完全反应可生成0.5molBr2。 取该溶液10mL加入足量乙醛溶液,使其褪色,然后将所得溶液稀释为100mL,准确量取其中10mL,加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g。若已知CH3COOAg易溶于水,试通过计算判断溴水与乙醛发生反应的类型为 (选填猜想序号)。
⑷写出上述测定过程中的三个反应的离子方程式:
①KBrO3和KBr在酸性条件下的反应 : ;
②溴水与乙醛的反应: ;
③测定Br—离子含量的反应: ;
四、(本题包括2小题,共22分)
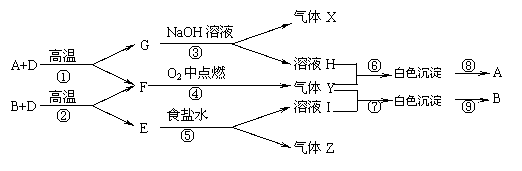 21.已知A、B、E是固体化合物,D、G是固体单质,X、Z、F为可燃性气体,F、X的火焰呈淡蓝色,他们之间有如下转化关系:
21.已知A、B、E是固体化合物,D、G是固体单质,X、Z、F为可燃性气体,F、X的火焰呈淡蓝色,他们之间有如下转化关系:
⑴写出A、B、Z的名称:A ,B ,Z
⑵写出Y的结构式: ,A的晶体结构类型: ,
溶液H的保存要求 ;
⑶按要求写出反应方程式:
①的化学方程式:
⑥离子方程式:
22.(1)周期表中前20号元素中有A、B、C、D、E五种元素。已知它们都不是稀有气体元素,且原子半径依次减小,其中A和E同族,A与C、B与E原子的电子层数都相差2。A、B原子最外层电子数之比为1∶4。A和C能以原子个 数比1∶1形成化合物。
①写出元素符号 A B D E
②B与D形成的化合物是 分子(填极性、非极性)。
③用电子式表示A和D形成化合物过程
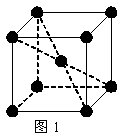
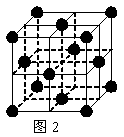
(2) 1183 K以下纯铁晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。
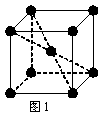
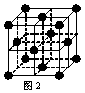
①在1183 K以下的纯铁晶体中,与铁原子等距离且最近的铁原子数为_______个;在1183 K以上的纯铁晶体中,与铁原子等距离且最近的铁原子数为___________;
②纯铁晶体在晶型转变前后,二者基本结构单元的边长之比为(1183 K以下与1183 K以上之比)___________。
③转变温度前后两者的密度比(1183 K以下与1183 K以上之比)_____________。
五、(本题包括2小题,共20 分)
23.有机物A与乙酸无论以何种比例混合,只要质量一定,完全燃烧后产生的水的质量也一定,试回答:
⑴若A与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则A的结构简式为_____________。
⑵若A由四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则A的结构简式为_____________。
⑶若A分子中C、H元素质量分数之和为86.67%,其余为O,且A的相对分子质量小于200,则A的分子式为___________。如果A分子每个碳原子都达到饱和,且能与金属钠反应产生氢气,则A的结构简式为________________________。
24.据报导,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS—Na(对氨基水杨酸钠)也是其中一种。它与雷米封可同时服用,可以产生协同作用。已知:
①![]() (苯胺、弱碱性、易氧化)
(苯胺、弱碱性、易氧化)
②![]()
下面是PAS—Na的一种合成路线(部分反应的条件未注明):

按要求回答问题:
⑴写出下列物质的结构简式:C:____________________D:______________________;⑵写出下列反应的化学方程式并配平
A→B:__________________________________________________________________;
B→C7H6BrNO2:__________________________________________________________;
⑶指出反应类型:I_________________,II_________________;
⑷指出所加试剂名称:X______________________,Y____________________。
六、计算题(本题包括2小题,共12分)
25.2.80g铁与100mL稀硝酸混合后充分反应,产生气体为NO,反应后铁、硝酸均无剩余。向反应后的溶液中加入100mL0.2mol/L的碘化钾溶液,恰好将溶液中的Fe3+全部还原。求原硝酸溶液的物质的量浓度?
26.据材料称:钠可在氮气中燃烧生成氮化钠,氮化钠与水反应的化学方程式是:
Na3N+4H2O==3NaOH+NH3·H2O。某学校化学研究学习小组,为了研究钠在空气中燃烧产物的成分,做了以下实验:
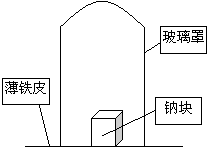 取11.5g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧产物投入水中,得到一种纯净气体0.224L(标准状态)和1000mL溶液,从中取出25.00mL溶液,和13.50mL 1.00mol·L-1HCl溶液刚好完全反应。求钠在空气中燃烧产物的成分及物质的量。
取11.5g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧产物投入水中,得到一种纯净气体0.224L(标准状态)和1000mL溶液,从中取出25.00mL溶液,和13.50mL 1.00mol·L-1HCl溶液刚好完全反应。求钠在空气中燃烧产物的成分及物质的量。
高三化学下学期期初考试试题
第Ⅱ卷 答题纸
 19.(1)_______(填代号,下同)(2)______(3)________ (4)
19.(1)_______(填代号,下同)(2)______(3)________ (4)
20.
(1) (填“是”或“否”),理由是 。
(2)n(Br—)= mol,n(Br—)= mol, n(Br—)= mol。
(3) (选填猜想序号)。
(4)写出上述测定过程中的三个反应的离子方程式:
① ;
② ;
③ ;
21.
(1)写出A、B、Z的名称:A ,B ,Z
(2)写出Y的结构式: ,A的晶体结构类型: ,
溶液H的保存要求 ;
(3)按要求写出反应方程式:
①的化学方程式:
⑥离子方程式:
22.
(1)①元素符号 A B D E
② 分子(填极性、非极性)。
③
(2)
①_______个;___________;②___________。③_____________。
23.(1)① ;
(2) ;
(3) ; 。
24.
⑴写出下列物质的结构简式:C:____________________D:______________________;⑵写出下列反应的化学方程式并配平
A→B:__________________________________________________________________;
B→C7H6BrNO2:__________________________________________________________;
⑶指出反应类型:I_________________,II_________________;
⑷指出所加试剂名称:X______________________,Y____________________。
25.解:
26.解: