高三化学喷泉实验
 喷泉实验,是高考常考内容,题型的设计屡有创新,难度在变化中递增。
喷泉实验,是高考常考内容,题型的设计屡有创新,难度在变化中递增。
●难点磁场
请试做下列题目,然后自我界定学习本篇是否需要。
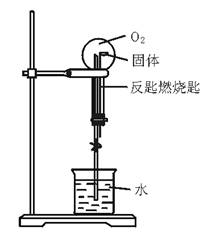
如图42—1所示,甲学生在烧瓶中充满O2,并在反匙燃烧匙中加入一种白色固体物质,欲做O2的喷泉实验。实验开始后,用凸透镜将日光聚焦于反匙燃烧匙中的固体,燃烧匙内出现一阵火光和白烟。等一会儿,打开橡皮管上的止水夹。甲理论分析认为,应该看到有美丽的喷泉发生。结果实验成功了。请问他在反匙燃烧匙中加入了什么物质?
●案例探究
[例题]都能用图42—2装置进行喷泉实验的一组气
体是 图42—1
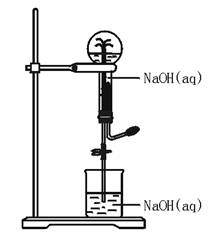
图42—2
A.HCl和CO2 B.NH3和CH4
C.SO2和CO2 D.NO2和NO
命题意图:考查学生对喷泉实验形成的根本原因的认识。
知识依托:理化交叉。物理方面,产生一定的压强差就能形成喷泉;化学方面,溶解与反应可使气体大量地减少。
错解分析:忽视NaOH(aq)可以吸收酸性气体,而产生喷泉,对A不敢确定,并且漏选C。
解题思路:首先要明确在装置中可以形成“喷泉”的原因。只要从滴管挤入的液体或溶液,能将烧瓶内的气体大量溶解或与之反应,使烧瓶内气体大量地减少,造成烧瓶内处于低压状态,此时,打开止水夹,烧杯内的液体或溶液将受大气压的影响迅速涌入烧瓶内,形成美丽的喷泉。
题中,HCl、CO2、NH3、SO2、NO2都能完全溶于NaOH(aq):
NaOH+HCl====NaCl+H2O 2NaOH+CO2====Na2CO3+H2O
NaOH+CO2====NaHCO3 2NaOH+SO2====Na2SO3+H2O
NaOH+SO2====NaHSO3 2NaOH+2NO2====NaNO3+NaNO2+H2O
由此进行组合,可知答案。
答案:AC
●锦囊妙计
1.形成喷泉的组合
(1)NH3、HCl、SO2、NO2与水组合能形成喷泉。
(2)酸性气体与NaOH(aq)组合能形成喷泉。
(3)有机气体与有机溶剂组合也能形成喷泉。
(4)O2、N2、H2等不溶于水的气体,设计一定实验条件将其反应掉,也能形成喷泉。
2.喷泉的计算
根据充入烧瓶中液体的体积可以计算烧瓶内所盛气体的纯度或平均式量。
3.喷泉的设计
关键是如何使烧瓶内的气体大量地减少。
●歼灭难点训练
1.(★★★)在体积为1 L的干燥烧瓶中,用排空气法充入HCl气体后,测得烧瓶中气体对氧气的相对密度为1.082,以此气体进行喷泉实验,当喷泉停止后,进入烧瓶中的液体体积是
A.![]() L B.
L B.![]() L C.
L C.![]() L D.全满
L D.全满
2.(★★★★)如图43—3,同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2,进行喷泉实验。经充分反应后,瓶内溶液的物质的量浓度为
A.①>② B.①<② C.①=② D.不能确定
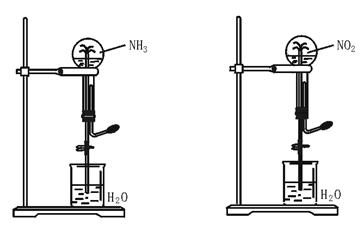
图42—3
3.(★★★★)喷泉是一种常见的自然现象,其产生原因是存在压强差。
(1)图42—4为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是
A.HCl和H2O
BNO2和H2O
C.NH3和H2O
DNCO2和NaOH(aq)
(2)某学生积极思考产生喷泉的其他办法,并设计了如图42—5所示的装置。 图42—4
①在图42—5的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是
A.Cu与稀盐酸 B.NaHCO3与NaOH(aq)
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
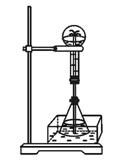 ②在图42—5锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冰水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是
②在图42—5锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冰水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是
A.浓硫酸 B.食盐
C.硝酸钾 D.硫酸铜
这种方法产生喷泉的原理是____________。
③比较图42—4和图42—5两套装置,从产生喷泉的原理来分析,图42—5是___________上部烧瓶内气体压强,图42—5是___________下部锥形瓶内气体压强(均填“增大”或“减小”)。 图42—5
(3)城市中常见的人造喷泉及火山爆发的原理与上述___________(填图42—4或图42—5)装置的原理相似。
4.(★★★★★)制取氨气并完成喷泉实验。
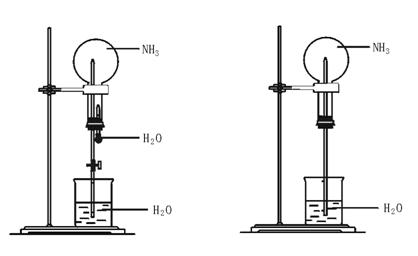
图42—6 图42—7
(1)写出实验室制取NH3的化学方程式: 。
(2)收集NH3应使用________法,要得到干燥的NH3可选用________做干燥剂。
(3)用图42—6装置进行喷泉实验,上部烧瓶已装满干燥NH3,引发水上喷的操作是________;该实验的原理是 。
(4)如果只提供如图42—7的装置,请说明引发喷泉的方法 。
附:参考答案
难点磁场
提示:反匙燃烧匙中应该是在强光照射下能与O2发生反应且不生成气体的物质。
答案:白磷
歼灭难点训练
1.C
2.解析:为方便计算,假定烧瓶容积为1 L,则:c(氨水)=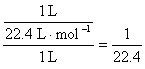 mol·L-1。由于3NO2+H2O====2HNO3+NO,所以,c(HNO3)=
mol·L-1。由于3NO2+H2O====2HNO3+NO,所以,c(HNO3)=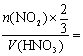
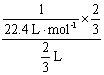
![]() mol·L-1。
mol·L-1。
答案:C
3.(1)B
(2)①D ②A 浓H2SO4溶于水放热,温度升高,酒精挥发加快,锥形瓶内气压增大 ③减少 增大
(3)图42—5
4.提示:本题(1)~(4)问,难度逐渐增大,体现了现代试题切入容易深入难的特点。(3)问形成喷泉的方法是将胶头滴管中的水挤入,目的是使NH3大量地减少。(4)问没有胶头滴管,由连接的导管来完成,可在导管中有一段空气,只须将它赶出,完成NH3与H2O的接触,就可形成喷泉。赶出导管中空气的方法有两个,①热敷法:在烧瓶上放热毛巾,烧瓶内气压增大,空气被赶出导管;冷敷法:在烧瓶上放包有冰块的冷毛巾,烧瓶气压减小,空气及水被压入烧瓶;都能形成喷泉。
答案:(1)2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2)向下排空气 碱石灰(或NaOH固体)
(3)打开止水夹,挤出胶头滴管中的水 氨气极易溶于水,致使烧瓶内气体压强迅速减小
(4)打开夹子,用手(或热毛巾)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉