高三化学平衡单元测试
(第Ⅰ卷共64分)
一、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个选项符合题意)
1.在实际生产中,反应2SO2(g)+O2(g)![]() 2SO3(g);△H<0,应选择的适宜条件是 ( )
2SO3(g);△H<0,应选择的适宜条件是 ( )
A.高温、高压、催化剂 B.低温、高压、催化剂
C.高温、低压、催化剂 D.适当温度、常压、催化剂
2.对于可逆反应2A+3B2-![]() 2C;△H<0,下列条件改变一定可以加快正反应速率的是( )
2C;△H<0,下列条件改变一定可以加快正反应速率的是( )
A.增加压强 B.升高温度 C.增加A的量 D.加入二氧化锰作催化剂
3.下列事实中,不能用勒沙特列原理解释的是( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.工业合成氨时选择比较适宜的温度500℃左右
C.实验室中常用排饱和食盐水的方法收集Cl2
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
4.在N2+3H2![]() 2NH3的平衡体系中,当分离出NH3时,下列说法正确的是( )
2NH3的平衡体系中,当分离出NH3时,下列说法正确的是( )
A.正反应速率增大 B.平衡向逆反应方向移动
C.正反应速率大于逆反应速率 D.逆反应速率先变小后变大
5.同温同压下,当反应物分解了8%,总体积也增加了8%的是 ( )
A.2NH3(气) ![]() N2(气)+3H2(气)
B.2NO(气)
N2(气)+3H2(气)
B.2NO(气) ![]() N2(气)+02(气)
N2(气)+02(气)
C.2N2O5(气) ![]() 4N0(气)+02(气) D.2SO2(气)
4N0(气)+02(气) D.2SO2(气) ![]() 02(气)+2SO2(气)
02(气)+2SO2(气)
6.某温度下,将2mol A和3molB充入一密闭容器中,发生反应:aA(g)+B(g)![]() C(g)+D(g) 5分钟后达到平衡。已知各物质的平衡浓度的关系为c(A)a c(B)=c(C)c(D),若在温度不变情况下将容器的体积扩大为原来的10倍,其A的转化率不发生变化,则B的转化率为
C(g)+D(g) 5分钟后达到平衡。已知各物质的平衡浓度的关系为c(A)a c(B)=c(C)c(D),若在温度不变情况下将容器的体积扩大为原来的10倍,其A的转化率不发生变化,则B的转化率为
A 60% B 24% C 4% D 40%
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个都正确的给4分,但只要选错一个,该小题就为0分)
7.关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛其化学机理为:
![]()
![]() ①HUr +
H2O
Ur— +
H3O+ ②Ur—(aq)+Na+(aq) NaUr(s)
①HUr +
H2O
Ur— +
H3O+ ②Ur—(aq)+Na+(aq) NaUr(s)
尿酸 尿酸根离子
下列对反应②叙述中正确的是( )
A.反应的△H>0 B.反应的△H<0
C.升高温度平衡向正反应方向移动 D.降低温度平衡向正反应方向移动
8.在一定条件下,合成氨反应达到平衡后,混和气体中NH3的体积占25%。若反应前后条件保持不变,则反应后缩小的气体体积与原反应物体积的比值为
 A 1/5 B 1/4 C 1/3 D 1/2
A 1/5 B 1/4 C 1/3 D 1/2
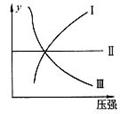
9.下图I、Ⅱ、Щ分别代表反应①③、②、④,则y轴是指 ( )
①N2+3H2![]() 2NH3
2NH3 ![]() H<0
H<0
②H2+I2(g)![]() 2HI
2HI ![]() H<0
H<0
③CO+2H2![]() CH3OH(g)
CH3OH(g)![]() H<0
H<0
④2SO3
![]() 2SO2+O2
2SO2+O2 ![]() H>0
H>0
A.平衡混合气中一种生成物的百分含量 B.平衡混合气中一种反应物的百分含量
 C.平衡混合气中一种生成物的转化率 D.平衡混合气中一种反应物的转化率
C.平衡混合气中一种生成物的转化率 D.平衡混合气中一种反应物的转化率
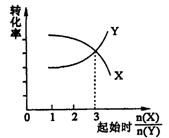
10.在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应,平衡后测得X,Y的转化率与起始时两物质的物质的量之比的关系如图所示,则X,Y的反应方程式可表示为 ( )
A.2X+Y![]() 3Z
B.3X+2Y
3Z
B.3X+2Y![]() 2Z
2Z
C.X+3Y![]() Z D.3X+Y
Z D.3X+Y![]() Z
Z
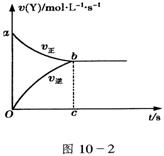 11.在容积固定为2L密闭容器中,充入X、Y各2mol发生可逆反应:X(g)+2Y(g)
11.在容积固定为2L密闭容器中,充入X、Y各2mol发生可逆反应:X(g)+2Y(g)![]() 2Zg达到平衡,以Y的浓度改变表示的化学反应速率v(正)、v(逆)与时间的关系如10-2图,则Y的平衡浓度的表达式正确的是(式中S指对应区域的面积)( )
2Zg达到平衡,以Y的浓度改变表示的化学反应速率v(正)、v(逆)与时间的关系如10-2图,则Y的平衡浓度的表达式正确的是(式中S指对应区域的面积)( )
A.2-Saob B.1-Saob C.2-Sabco D.1-Sboc
12.某可变的密闭容器中,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B![]() 2C。若保持温度和压强不变,当达到平衡时,容器的体积为V(L),其中C气体的体积占10%,下列推断正确的是( )
2C。若保持温度和压强不变,当达到平衡时,容器的体积为V(L),其中C气体的体积占10%,下列推断正确的是( )
A.原混合气体的体积为1.2V(L) B.原混合气体的体积为1.1V(L)
C.反应达平衡时气体A消耗掉0.05V(L) D.反应达平衡时气体B消耗掉0.05V(L)
13.一体积固定的密闭容器充入CO和 H2O(气)各1mol一定条件下发生反应:CO+
H2O(气) ![]() CO2+H2;△H<0。平衡后测的CO的转化率为60% ,保持其他条件不变向容器中再充1mol H2O(气),达平衡后CO2的体积百分数可能为 ( )
CO2+H2;△H<0。平衡后测的CO的转化率为60% ,保持其他条件不变向容器中再充1mol H2O(气),达平衡后CO2的体积百分数可能为 ( )
A.10% B.20% C.30% D.40%
14.在相同容积的4个密闭器中进行同一种可逆反应,2A(g)+B(g) ![]() 3C(g)+2D(g),起始时4个容器所盛A、B的量如下表所示:
3C(g)+2D(g),起始时4个容器所盛A、B的量如下表所示:
| 容器 | 甲 | 乙 | 丙 | 丁 |
| A | 2 mol | 1 mol | 2 mol | 1 mol |
| B | 1 mol | 1 mol | 2 mol | 2mol |
在相同温度下,建立平衡时,4个容器中A或B的转化率的大小关系是 ( )
A.A的转化率为:甲<丙<乙<丁 B.A的转化率为:甲<乙<丙<丁
C.B的转化率为:甲>丙>乙>丁 D.B的转化率为:丁>乙>丙>甲
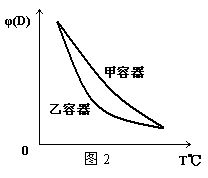
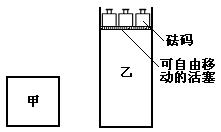
15.一定温度下,有可逆反应:2A(g)+2B(g)![]() C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
 | |||
 | |||
|
关于两容器中反应的说法正确的是
A.甲容器中的反应先达到化学平衡状态
B.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同
C.两容器达平衡后升高相同温度,两容器中物质D的体积分数随温度变化如图2 所示
D.在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的浓度是乙中物质C的浓度的2倍
16.在一固定容积的密闭容器中,加入m mol A、n mol B,发生下列反应:mA(g)+nB(g)![]() pC(g) 平衡时C的浓度是wmol/L,若容器体积和温度不变,起始时放入a mol A、b mol B、c mol C,若要平衡后C的浓度仍为wmol/L,则a、b、c应满足的关系是( )
pC(g) 平衡时C的浓度是wmol/L,若容器体积和温度不变,起始时放入a mol A、b mol B、c mol C,若要平衡后C的浓度仍为wmol/L,则a、b、c应满足的关系是( )
A.a︰b︰c=m︰n︰p B.a︰b=m︰n (ap/m)+c=p
C.(mc/p)+a=m,(nc/p)+b=n D.a=m/3,b=n/3,c=2p/3
(第Ⅱ卷共86分)
三、(本题包括2小题,共22分)
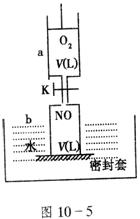 17.(12分)如图10-5(a中活塞的质量与筒壁的摩擦力不计;与K相连的细管的体积也忽略不计)。在标准状况下:
17.(12分)如图10-5(a中活塞的质量与筒壁的摩擦力不计;与K相连的细管的体积也忽略不计)。在标准状况下:
(1)b中气体与水不接触,打开K,足够长时间后,a中气体体积减少范围是:___________△V(减小)___________。
(2)在上述(1)之后,快速推a中活塞至a中气体全部进入b中,观察到的现象是_________________________,原因是____________________________________________。
(3)若固定a中活塞如图10-5所示,打开K,移走b的密封套,足够长时间后,观察到的现象是___________________________
_________________________________________________,所得溶质的物质的量浓度为(设溶质不扩散到水槽中)__________________。
18.(10分)反应CaCO3![]() CaO+在不同温度下,CO2的平衡压强如下表:
CaO+在不同温度下,CO2的平衡压强如下表:
| 温度/℃ | 550 | 650 | 750 | 850 | 897 |
| 压强/Pa | 5.32×10 | 9.17×102 | 8.37×103 | 4.34×104 | 1.01×105 |
根据上表数据,填写下列空白:
(1)若升高原CaCO3的分解平衡体系的温度,同时给反应容器加压,则原平衡______。
A.向逆反应方向移动 B.向正反应方向移动
C.不移动 D.无法确定平衡移动方向
(2)在一个不与外界进行热交换的密闭器中足量的CaCO3在850℃时建立分解平衡。若将该容器的容积扩大为原来的2倍,需重新达到平衡时,容器内的温度将_______________,CaCO3的分解率将____________________________,CO2的平衡压强将________(填“>”、“=”、“<”)4.34×104Pa,其理由是_________________ ________________ ___
。
四、(本题包括2小题,共22分)
19.(12分)在100℃时,将0.100mol的四氧化二氮气体充入1 L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下数据:
|
c/mol·L—1 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/mol·L—1 | 0.100 | c1 | 0.050 | C3 | a | b |
| c(NO2)/mol·L—1 | 0.000 | 0.060 | C2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应的化学方程式为________________ ______,达到平衡时四氧化二氮的转化率为_____ _,表中c2、c3、a、b大小关系为: 。
(2)20 s时四氧化二氮的浓度c1==____________mol·l—1,在0s~20s内四氧化二氮的平均反应速率为___________mol·(L·s)—1
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是_________mol·L—1。
20.(10分)t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(气)+B(气) ![]() xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
(1)x=__________。
(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)= ;
(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是____________(填写字母序号)
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变
(4)在t℃时,若向原平衡混合物的容器中再充入amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入____ ______(填A或B)________mol(用a表示)。
五、(本题包括2小题,共21分)
21.(9分)在一个容积固定的反应器中,有一可左右滑动的密封隔板两侧分别进行如图所示的可逆反应 :
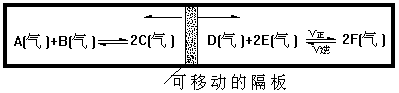
各物质的起始加入量如下:A、B和C均为4.0mol,D为6.5mol、F为2.0mol,设E为xmol。当x在一定范围内变化时,均可以调节反应器的温度,使两侧反应均达到平衡,并且隔板恰好处于反应器的正中位置。请回答以下问题:
(1)若x等于4.5,则右侧反应在起始时向 方向移动,欲使起始反应维持向该方向进行,则x的最大取值范围是:
(2)若x分别为4.5和5.0时,则在这两种情况下,当反应达到平衡时,A的物质的量
(填“相等”或“不相等”)
22.(12分)在537℃时,往容积可变的密闭容器中充入2molSO2(g)、1molO2(g),此时容器的体积为200L,压强为1.01×105Pa。向容器中加入固体催化剂,并保持恒温恒压,发生反应:2SO2+O2 ![]() 2SO3,
2SO3,
达到平衡时,平衡气体中SO3的体积分数为0.91。试回答下列问题:
(1)从理论上看,压强增大,平衡向正反应方向移动,SO2的转化率增大。但工业上二氧化硫催化氧化采用常压而不用高压,主要的原因是 。
(2)保持上述温度和压强不变,若向容器中只充入2molSO3,并加入固体催化剂,则平衡时SO2的体积分数是 ,此时平衡混合气体的体积是 。
(3)温度仍保持537℃,容器的体积保持200L不变。充入amol SO2和bmolO2,并加入固体催化剂,反应达到平衡时,SO3的体积分数仍为0.91,体系压强为1.01×105Pa。若a:b=2:1,则a= 。
六、(本题包括2小题,共18分)
23.(8分)图10-7为一恒压容器。在恒定温度下,将1molN2和3molH2混合后由A口快速充入容器,封闭A,反应N2+H2![]() 2NH3在t1时刻达到平衡,t2时刻再从A口快速充入一定量NH3,封闭A,t3时刻重新达平衡至t4。在图10-8画出0→t4时间段内混合气中NH3的体积分数(y坐标)随时间(x坐标)变化的曲线 。
2NH3在t1时刻达到平衡,t2时刻再从A口快速充入一定量NH3,封闭A,t3时刻重新达平衡至t4。在图10-8画出0→t4时间段内混合气中NH3的体积分数(y坐标)随时间(x坐标)变化的曲线 。

24.(10分)将amolA(g)、dmolD(g)置于体积可变的密闭容器中加热至一定温度,发生如下反应:
2A(g) ![]() 2B(g)+C(g),2D(g)+C(g)
2B(g)+C(g),2D(g)+C(g) ![]() 2E(g)
2E(g)
t min时建立平衡,平衡时测得B的物质的量为mmol,C的物质的量为n mol,试求:
(1)平衡时,D的物质的量 (用d、m、n的代数式表示)
(2)平衡时若温度压强与反应前相同,则反应前和平衡时气体的密度之比为多少?(用含a、d、m、n的代数式表示)