高三化学平衡结果求取值
通常是由起始数据求平衡结果,反其道则难度增加,若由平衡结果求取值范围,则更难。
●难点磁场
请试做下列题目,然后自我界定学习本篇是否需要。
若273 K下,某容器容积为10.0 L,容器内存在如下平衡:
2NO2+4SO2 ![]() 4SO3+N2
4SO3+N2
各物质起始量分别是:NO2:2.0 mol、SO2:a mol、SO3:4.0 mol、N2:1.2 mol;平衡时容器内气体的总物质的量8.0 mol。只要a的取值合理,按上列数值投料平衡就不会发生移动,此时a为 。
●案例探究
[例题]在一个容积固定的反应器(如图19—1)中,有一可左右滑动的密封隔板,两侧分别进行如图19—1所示的可逆反应。各物质的起始加入量如下:A、B和C均为4.0 mol、D为6.5 mol、F为2.0 mol,设E为x mol 。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置。请填写以下空白:
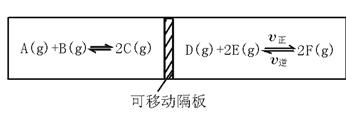
图19—1
(1)若x=4.5,则右侧反应在起始时向 (填“正反应”或“逆反应”)方向进行。欲使起始反应维持向该方向进行,则x的最大取值应小于___________。
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达到平衡时,A的物质的量是否相等?___________(填“相等”“不相等”或“不能确定”)。其理由是 。
命题意图:化学平衡移动考题,以前是求x的某一个具体数值,本题是求x的一个范围,这主要是对学生创新思维能力的考查。
知识依托:勒夏特列原理。
错解分析:通常平衡计算题是已知起始量求平衡结果,本题反其道而行之,已知平衡结果,求起始量的取值范围,增大了试题难度,结果:(1)不少学生不会解。(2)问答错的主要原因是忽视了左右两容器内温度相同这一客观条件。
解题思路:(1)由于左侧反应为气体物质的量不变的反应,无论平衡如何移动,左侧气体总物质的量总是:4.0 mol+4.0 mol+4.0 mol=12.0 mol。当x=4.5时,反应起始时右侧气体总物质的量为:6.5 mol+4.5 mol+2.0 mol=13.0 mol。要使隔板位于反应器中间,右侧反应最终结果必须是:气体物质的总物质的量与左侧相等,即12.0 mol;这样,右侧反应必须向气体物质的量缩小的方向,即该反应的正反应方向移动(评注:原题中说成:“右侧反应起始时向××方向进行”是不确切的,因为只要可逆反应一开始,就会同时向正、逆两个反应方向进行)
下面求x的最大取值。
方法①(列方程法):设达到平衡时,D的物质的量消耗 a mol,则:
D(g) + 2E(g) ![]() 2F(g)
2F(g)
n始 6.5 mol x mol 2.0 mol
n平 (6.5-a) mol (x-2a)mol (2.0+2a)mol
![]() (6.5-a)mol+(x-2a)mol+(2.0+2a)mol=12.0
mol
(6.5-a)mol+(x-2a)mol+(2.0+2a)mol=12.0
mol
那么, (6.5-a)mol>0 mol
(x-2a)mol>0 mol
解得:x<7.0
方法②(极限思维):由于起始时反应向正方向进行,则它的极限结果是nD=0或nE=0,二者具其一或其二,这时x可取最大值。
D(g) + 2E(g) ![]() 2F(g)
2F(g)
n始 6.5 mol x mol 2.0 mol
极限① 0 mol (x-13)mol 15 mol
极限② (6.5-x/2) mol 0 mol (2.0+x)mol
由极限①得:(x-13)mol+15 mol=12.0 mol,解得:x=10,此时:nE=(x-13) mol=-3 mol,显然不合题意,应舍去。
由极限②得:(6.5-x/2)mol+(2.0+x)mol=12.0 mol,解得:x=7.0 mol,可见,x的最大极限为7.0,即x<7.0,因为当x=7.0时,nE=0 mol,显然不合题意。
(2)只要注意题设:“x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,…。”显然,当x=4.5和5.0时,右侧反应的温度是不一样的,那么,整个反应器的温度也是不一样的,这对于左侧反应来说,是在不同的温度下建立的平衡,A的物质的量是不相等的。
答案:(1)正反应 7.0
(2)不相等 因为这两种情况是在两个不同温度下达到化学平衡的,平衡状态不同,所以A物质的量不相同
●锦囊妙计
由平衡结果求取值有两种方法:
1.列方程法:根据反应移动的方向,设出某反应物消耗的量,然后列式求解。
2.极限思维:有口诀如下:
始转平、平转始,欲求范围找极值。
极限思维是解此类问题的常用方法。
●歼灭难点训练
1.(★★★)题设同例题,求右侧平衡不移动时x的取值。
2.(★★★★)题设同例题,求右侧平衡起始时向逆反应方向移动的x的取值范围。
3.(★★★★)若nD=3.0 mol,不论平衡如何移动,其他条件同例题,求x的取值范围。
4.(★★★★★)在某条件下,容器中有如下平衡反应:
A+4B ![]() 2C+D(正反应放热)
2C+D(正反应放热)
此时,A、B、C的物质的量均为a mol,而D的物质的量为d mol。
(1)改变a的取值,再通过改变反应条件,可以使反应重新达到平衡,并限定达到新的平衡时,D的物质的量只允许在d/2到2d之间变化,则a的取值范围 (用a和d的关系式表示)。
(2)如果要使本反应重新建立的平衡中,D的物质的量只允许在d到2d之间取值,则应该采取的措施是 (从下面列出的选项中选择)。
A.升高反应温度 B.增大反应容器内之压强
C.增大反应容器容积 D.降低反应温度
E.减小反应容器内之压强 F.减小反应容器容积
附:参考答案
难点磁场
提示:273 K下,SO3是固体。
答案:4.8 mol
歼灭难点训练
1.解析:右侧平衡不移动,表明起始时,右侧气体总物质的量与左侧相等,为12.0 mol。则:
6.5 mol+x mol+2.0 mol=12.0 mol
x=3.5
答案:x=3.5
2.解析:仿照例题,本题有以下两种解法。
方法①:设右侧反应向逆反应方向移动达到新的平衡时,D物质的量增大b mol。则:D(g) +
2E(g) ![]() 2F(g)
2F(g)
n始 6.5 mol x mol 2.0 mol
n平 (6.5+b) mol (x+2b) mol (2.0-2b)mol
由n始得:6.5 mol+x mol+2.0 mol<12.0 mol
解得x<3.5
![]() (6.5+b)mol+(x+2b)mol+(2.0-2b)mol=12.0
mol
(6.5+b)mol+(x+2b)mol+(2.0-2b)mol=12.0
mol
由n平得:
(2.0-2b)mol>0 mol
解得:x>2.5。
可见x的取值范围是:2.5<x<3.5
方法②:
D(g) + 2E(g)![]() 2F(g)
2F(g)
n始 6.5 mol x mol 2.0 mol
极限 7.5 mol (x+2.0) mol 0 mol
![]() 6.5 mol+x mol+2.0
mol<12.0 mol
6.5 mol+x mol+2.0
mol<12.0 mol
由题意得:
7.5 mol+(x+2.0) mol+0 mol>12.0 mol
解得:2.5<x<3.5
答案:2.5<x<3.5
3.解析:仿照例题,本题有两种解法。
方法①:设反应向右移动而达平衡时,nD减少a mol,反应向左移动而达平衡时,nD增加b mol。
D(g) + 2E(g) ![]() 2F(g)
2F(g)
n始 3.0 mol x mol 2.0 mol
n平① (3.0-a) mol (x-2a)mol (2.0+2a)mol
n平② (3.0+b) mol (x+2b) mol (2.0-2b)mol
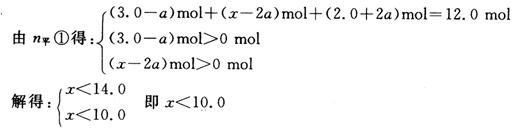
![]() (3.0+b)mol+(x+2b)mol+(2.0-2b)mol=12.0
mol
(3.0+b)mol+(x+2b)mol+(2.0-2b)mol=12.0
mol
由n平②得:
(2.0-2b) mol>0 mol
解得:x>6.0
可见,6.0<x<10.0
方法②: D(g) + 2E(g) ![]() 2F(g)
2F(g)
n始 3.0 mol x mol 2.0 mol
极限① 0 mol (x-6.0)mol 8.0 mol
极限② (3.0-x/2) mol 0 mol (2.0+x)mol
极限③ 4.0 mol (x+2.0)mol 0 mol
由极限①:(x-6.0)mol+8.0 mol=12.0 mol x=10.0
由极限②:(3.0-x/2)mol+(2.0+x)mol=12.0 mol x=14.0 (×)
由极限③:4.0 mol+(x+2.0)mol=12.0 mol x=6.0
则:6.0<x<10.0
答案:6.0<x<10.0
4.提示:(1) A + 4B ![]() 2C + D (ΔH<0
2C + D (ΔH<0![]()
已知平衡 a mol a mol a mol d mol
极限① (a+d/2)mol (a+2d)mol (a-d)mol d/2 mol
极限② (a-d)mol (a-4d)mol (a+2d)mol 2d mol
(横线上式子可不列出)
由极限①:a-d>0;由极限②:a-4d>0,且a-d>0; 则:a>4d。
(2)不知道A、B、C、D聚集状态,可排除B、C、E、F选项,从而选D。
答案:(1)a>4d (2)D