高三化学假期练习
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分150分,考试时间120分钟。
第Ⅰ卷(选择题 共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1、2005年4月22日是第36个“世界地球日”,我国国土资源部确定今年“世界地球日”的主题为“善待地球—科学发展,构建和谐”。你认为下列行为中不符合这一主题的是
A、开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料
B、控制含磷剂的生产和使用,防止水体富营养化,保护水资源
C、研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展
D、实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle)
2、最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
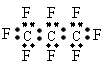 A、分子中三个碳原子可能处于同一直线上
A、分子中三个碳原子可能处于同一直线上
B、全氟冰烷的电子式为:
C、相同压强下,沸点:C3F8<C3H8
D、全氟冰烷分子中既有极性键又有非极性键
3、下列有关说法正确的是
A、胶体能够较稳定存在的根本原因是胶粒作布朗运动
B、铝丝和铜丝用导线连接后插入冷的浓硝酸溶液中构成原电池,铝为负极
C、氯化钠投入到酒精中将形成胶体
D、蛋白质溶液中加入氯化汞溶液能使其发生盐析
4.有关晶体的叙述中正确的是
A.在SiO2晶体中,由Si、O构成的最小单元环有8个原子
B.在12 g金刚石中,含C—C共价键键数为4NA
C.在含阳离子的化合物晶体中一定含阴离子
D.原子晶体的熔点一定高于离子晶体
5.下列叙述中正确的是
①金属钠不能与NaOH溶液反应;②液溴中溶有少量氯气,可以用加入溴化钠再用汽油萃取的方法提纯;③溴化银具有感光性,碘化银不具感光性;④某溶液与淀粉碘化钾溶液反应出现蓝色,则证明该溶液是氯水或溴水;⑤氟气能与氯化钠水溶液反应生成HF和O2;⑥氯气跟水反应时,水既不是氧化剂也不是还原剂。
(A)①③⑤ (B)②④⑥ (C)②⑤⑥ (D)①③④
6. 据报道,N5是破坏力极强的炸药之一,18O2是比黄金还贵重的物质。下列说法正确的是
A. 18O2中含18个中子 B. 原子半径:N<18O
C. N5和N2互为同位素 D. 2N5 = 5N2是化学变化
7. 近期,北京大学的两位教授率先发现人体心肺血管中存在微量硫化氢,它对调节心血管功能具有重要作用。下列叙述正确的是
A. 硫化氢分子很稳定,受热难分解
B. 硫化氢分子中所有原子的最外电子层都达到8电子结构
C. 将硫化氢通入溴水,溴水褪色
D. 硫化氢是电解质,其电离方程式是 H2S = 2H+ + S2-
8. 下列说法中,不正确的是
A. 在NaAlO2溶液中,HCO3-不可能大量存在
B. 在0.1mol·L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)减小
C. 在由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3+不可能大量存在
D. 室温下pH=6的酸性溶液中,可能存在NH3·H2O分子
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。)
9、以NA 表示阿伏加德罗常数,下列说法正确的是
A、如果5.6L N2含有n个氮分子,则阿伏加德罗常数一定约为4n
B、15.6g Na2O2 与过量CO2反应时,转移的电子数为0.2NA
C、1L 1mol/L 的FeCl3溶液中含有铁离子的数目为NA
D、T℃时,1 L pH=6纯水中,含10—6NA个OH—
10. 10.30℃时,在0.1mol/L的Na2S、NaHS两溶液中均存在的关系是
A.c(H+)·c(OH-)>1×10-14 B.c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.c(OH-)=c(H+)+c(HS-)+2c(H2S) D.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
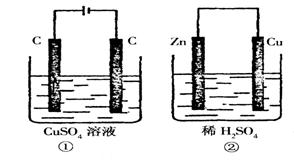 11.如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.lmol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是.
11.如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.lmol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是.
A.产生气体的体积:①>②
B.电极上析出物质的质量: ①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式:
①中阳极:![]() ;
;
②中阳极:![]()
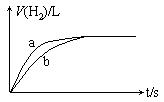 12.一定质量的Na、K分别投入一定量的稀盐酸中,在相同条件下产生氢气的体积随时间变化的曲线如图中a、b所示,则下列说法中正确的是( )
12.一定质量的Na、K分别投入一定量的稀盐酸中,在相同条件下产生氢气的体积随时间变化的曲线如图中a、b所示,则下列说法中正确的是( )
A、投入的Na、K物质的量一定相等
B、曲线a对应的反应使用了催化剂
C、曲线a代表K的反应,曲线b代表Na
D、两反应中盐酸必须是足量的
13.将一定量的Na—Al合金置于水中,合金完全溶解,得到20mL pH=14的溶液,然后用1 mol·L-1盐酸滴定至沉淀量最大时,消耗40mL盐酸,则原合金中钠的物质的量
A.0.01mol B.0.02molYCY C.0.03mol D.0.04mol
14.配制250mL0.1 mol·L-1的盐酸时,下列实验操作将使配制溶液浓度偏大的是
A.用量筒量取所需浓盐酸俯视刻度线
B.定容时仰视刻度线
C.用量筒量取所需浓盐酸倒入烧杯后,再用水洗量筒2—3次,洗液倒入烧杯中
D.定容后倒转容量瓶几次,发现液面最低点低于标准,再补几滴水至标线
15、对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是
A、若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,
则m+n>p+q
B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为
m:n
C、若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)
D、温度不变时,若压强增大至原来的2倍,达到新平衡时,总体积一定比原体积的1/2要小
16、下列离子方程式不正确的是
A、三氯化铝溶液中加入过量氨水:Al3++3OH―![]() Al(OH)3↓
Al(OH)3↓
B、4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合:
4AlO2―+7H++H2O![]() 3Al(OH)3↓+Al3+
3Al(OH)3↓+Al3+
C、在Mn2+的溶液中加入HNO3再加入PbO2,得紫红色溶液:
5PbO2+2Mn2++4H+![]() 5Pb2++2MnO4-+2H2O
5Pb2++2MnO4-+2H2O
D、将0.1mol/L盐酸数滴缓缓滴入0.1mol/L25mLNa2CO3溶液中,并不断搅拌:
2H++CO32-![]() CO2↑+H2O
CO2↑+H2O
17. AB3是短周期两种元素形成的化合物,已知B原子比A原子多一个电子层,且AB3分子中所有原子的最外层都满足8电子结构,则下列说法正确的是
A. A是IIIA族元素
B. AB3是三氧化硫
C. B的氢化物和A的氢化物都极易溶于水
D. B原子比A原子多10个电子
18、某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录了t℃的4份相同的硫酸铜溶液中加入的无水硫酸铜的质量以及析出的硫酸铜晶体(CuSO4·5H2O)的质量(温度维持不变)的实验数据
| 硫酸铜 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 加入的无水硫酸铜(g) | 2.5 | 4.0 | 6.0 | 8.0 |
| 析出的硫酸铜晶体(g) | 0.10 | 2.8 | 6.4 | 10.0 |
当加入4.6g无水硫酸铜时,析出硫酸铜晶体的质量为
A、3.42g B、3.88g C、6.82g D、2.56g
请将选择题答案填入下表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第II卷(选择题 共78分)
三、(本题包括2小题,共22分)
19.(10分)工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是:
2FeSO4 ![]() Fe2O3+SO2↑+SO3↑。某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
Fe2O3+SO2↑+SO3↑。某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
(SO2沸点为-10.02℃)
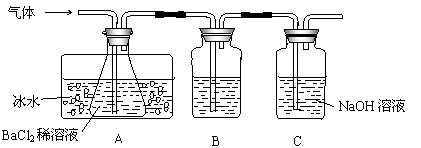 |
请回答相关问题:
(1)A瓶所盛试剂的作用是 ;B瓶所盛的试剂是 ;C瓶所盛试剂的作用是 。
(2)A瓶要用冷水冷却的原因是 。
(3)将此反应生成的气体通入A瓶BaCl2溶液中,则 。(填编号)
A.析出BaSO3沉淀 B.析出BaSO4沉淀
C.逸出SO3气体 D.逸出SO2气体
(4)反应后若用A瓶内的混合物来测定已分解的FeSO4的质量,其实验操作的第一步是(简述操作步骤) 。
20.(12分)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
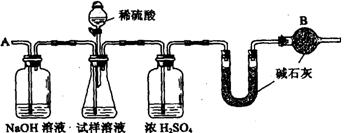
主要实验步骤如下:
① 按图组装仪器,并检查装置的气密性
② 用托盘天平称取6.0 g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量得到32.6 g
④ 从分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到34.8 g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变。
请填空和回答问题:
(1)在③步骤中称量质量时涉及到多步添加,撤去法码的操作,请用“↓”表示在托盘上加上砝码,“↑”表示从托盘上取下砝码的称量过程。(法码有50g、20g、10g、5g、2g、1g等多种规格,1g以下移动游码)注:表格可不填满
| 砝码质量/g | 50 | 20 | |||||||
| 称量过程 | ↓↑ |
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、偏低或不变)
(4)步骤⑤的目的是_____________________________、A中NaOH溶液的作用是________________________________________________________________。
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数为(精确到0.1) .
四、(本题包括2小题,共18分)
21.(10分)甲状腺激素对于人和高等动物具有极其重要的生理作用,下图是关于碘及其化合物与甲状腺素的转化网络图示。
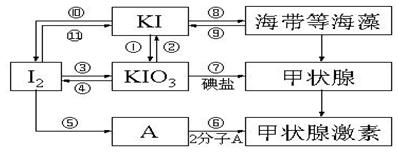
(1)请写出在强酸性条件下,由KI和KIO3反应制得I2的离子反应方程式:_____________________________________________________________________。
(2)上述各反应中,碘元素发生氧化反应的过程有_________________ (填序号)。
(3)制备KIO3的方法较多:
③的原理是I2在一定条件下还原KClO3,写出该反应的化学方程式:________
_____________![]()
![]()
![]() ___________________________________________。
___________________________________________。
① 的原理是以石墨为阳极,不锈钢为阴极,KI溶液为电解质溶液(混有K2Cr2O7)电解,总反应方程式为KI+3H2O![]() KIO3+3H2↑。①试写出阴极反应方程式:________
______________________________________________________________。
KIO3+3H2↑。①试写出阴极反应方程式:________
______________________________________________________________。
22、(8分)麻醉剂的发现和使用,是人类医疗史上了不起的一项成就,它可使患者在接受治疗时感觉不到疼痛。
(1)笑气是人类最早应用于医疗的麻醉剂之一,它可由NH4NO3在微热条件下分解产生,产物除N2O外还有一种,此反应的化学方程式为
。有关理论认为N2O与CO2分子具有相似的结构(包括电子式),则其空间构型是 型,N2O为 分子(极性或非极性)
(2)另一种麻醉剂为乙醚(C2H5-O-C2H5),乙醚和正丁醇(C4H9OH)互为同分异构体,但两者之间沸点差异较大,其中沸点高的是(填名称)_______________,沸点高的原因是___________________________________________。
五、(本题包括2小题,共20分)
23.(10分)已知A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。
②常温下将气体D通入水中发生反应,生成C和E。
③工业上以A、空气和水为原料,通过催化氧化法制成E。
请回答以下问题:
(1)A分子的空间构型是 ;B分子的电子式为 ;含Y元素的氧化物且属于酸酐还有:________ 。
(2)写出②中反应的化学方程式: 。
(3)由B反应生成1molA放出的热量为46.2kJ,写出该反应的热化学方程式:
__________________________________________________________________________
 (4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应化学方程式:
;若反应有6NA ( NA表示阿伏加德罗常数)电子发生转移,则有
mol的A被氧化。
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应化学方程式:
;若反应有6NA ( NA表示阿伏加德罗常数)电子发生转移,则有
mol的A被氧化。
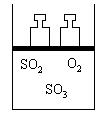
24. (10分)如右图所示,将4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)
![]() 2SO3(g);ΔH<0。该反应达到平衡状态A时,测得气体总物质的量为4.2mol。
2SO3(g);ΔH<0。该反应达到平衡状态A时,测得气体总物质的量为4.2mol。
若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,回答下列问题:
(1)在达到平衡状态A的容器中通入少量O2,体系中SO2的体积分数_________(填“增大”或“减小”或“不变”),若要使SO2的体积分数再变到与平衡状态A相同,可采取的措施有:______________________或_____________________。
(2)若起始时a=1.2mol,b=0.6mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时c的取值为___________。
(3)若要使反就开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时c的取值范围是____。
六、(本题包括2小题,共18分)
25.(6分)环保检测部门测定某气体样品中含一氧化碳的含量,其方法和实验步骤如下:
① 将2.000L的气体样品通过盛有I2O5固体的加热管,发生的反应为:
5CO + I2O5 ![]() 5CO2
+ I2。
5CO2
+ I2。
② 将所产生的碘升华,并加入30.00mL 0.0050 mol·L-1的硫代硫酸钠溶液,发生的反应为:
I2 + 2S2O32- = 2I-+ S4O62-
③ 将②中溶液取出![]() ,加入1.000mL 0.0100 mol·L-1的碘水,正好将所取溶液中过量的Na2S2O3全部氧化。
,加入1.000mL 0.0100 mol·L-1的碘水,正好将所取溶液中过量的Na2S2O3全部氧化。
试计算1L该气体样品中有多少毫克(mg)的CO?
26、(12分)在NO2和O2的混合气体中,NO2所占的体积分数为x。用容积为50mL的容器盛满该混合气体并倒立于水中,足够长的时间后,容器内剩余VmL气体。
⑴试确定x的取值范围与剩余气体体积V的函数关系:V=f(x)。
⑵若最终剩余10mL气体,则原混合气体中NO2的体积分数是多少?
⑶若原50mL混合气体中含有少量N2(小于1mL),请判断在上述条件下,这些N2的存在对第⑵题的计算结果有无影响。