高三化学较难氧化还原方程式的配平
氧化还原方程式的配平,技巧若不掌握,就会觉得很难;掌握了其配平技巧,就会觉得较易。
●难点磁场
请试做下列题目,然后自我界定学习本篇是否需要。
将红磷放在稀硝酸中加热,发生如下反应,所列方程式中还缺少一种反应物(或生成物,只添其一),请完成下列化学方程式:
______P+______HNO3+__ ______![]() ______H3PO4+______NO↑
______H3PO4+______NO↑
●案例探究
[例题]配平下列化学方程式:
___PbN6+___Cr(MnO4)2![]() ___Cr2O3+___MnO2+___Pb3O4+___NO↑
___Cr2O3+___MnO2+___Pb3O4+___NO↑
命题意图:考查学生对氧化还原方程式的配平能力。属化学教学中要求掌握的内容。
知识依托:氧化还原方程式的配平。
错解分析:不能正确辨认PbN6和Cr(MnO4)2中各元素的化合价,可造成本题错解、难解,甚至不会解。
解题思路:本题有以下两种解法:
方法1(0价配平法):对分子中含有难以确定元素化合价的物质,可选其为配平标准,并设该分子中各元素的化合价都为0(或在满足化合物内各元素化合价代数和为0的前提下设为其他数值),对配平结果无影响:
①题给反应中PbN6和Cr(MnO4)2中Pb、N、Cr、Mn四元素的化合价难以确定,可选PbN6和Cr(MnO4)2为配平标准:
![]() ↑
↑
↑ ↓
44/3 5
![]()
![]() ②5PbN6+44/3Cr(MnO4)2
②5PbN6+44/3Cr(MnO4)2![]() Cr2O3+ MnO2+ Pb3O4+ NO↑
Cr2O3+ MnO2+ Pb3O4+ NO↑
↑ ↓
44/3×5 5×44/3
③15 PbN6+44 Cr(MnO4)2![]() ____Cr2O3+____MnO2+____Pb3O4+____NO↑
____Cr2O3+____MnO2+____Pb3O4+____NO↑
④15 PbN6+44 Cr(MnO4)2====22Cr2O3+88 MnO2+5 Pb3O4+90 NO↑
方法2(万能配平法):先设出化学方程式中某些物质的化学计量数,一般是方程式一边的化学计量数,即反应物(或生成物)的化学计量数,通常用1,x,y,z等数字和字母表示,然后根据原子个数守恒可求出x,y,z等未知数,这种方法几乎对所有化学方程式都是适合的,所以叫做万能配平法。
①1 PbN6+x Cr(MnO4)2![]() ______Cr2O3+______MnO2+______Pb3O3+______NO↑
______Cr2O3+______MnO2+______Pb3O3+______NO↑
②先根据Cr、Mn、Pb、N原子个数守恒,得出生成物的暂定计量数:
PbN6+x Cr(MnO4)2![]() x/2 Cr2O3+2x MnO2+1/3 Pb3O4+6 NO↑
x/2 Cr2O3+2x MnO2+1/3 Pb3O4+6 NO↑
6 PbN6+6x Cr(MnO4)2![]() 3x Cr2O3+12x MnO2+2 Pb3O4+36 NO↑
3x Cr2O3+12x MnO2+2 Pb3O4+36 NO↑
再根据O原子守恒得到下列等式,并求出x:
48x=9x+24x+8+36
x=44/15
③15 PbN6+44 Cr(MnO4)2====22 Cr2O3+88 MnO2+5 Pb3O4+90 NO↑
答案:15 44 22 88 5 90
●锦囊妙计
较难氧化还原方程式的配平,经常用到以下方法:
1.0价配平法
当化学方程式中某些元素的化合价较难确定时,通常采用0价配平法,所选配平标准可以是反应物,也可以是生成物。
2.万能配平法
万能配平法所配平的化学方程式只是原子个数守恒,化合价的升降总值不一定相等,因而不一定正确,虽然中学阶段很少遇到这样的化学方程式,但在最后进行化合价升降总值是否相等的验证,还是必要的。
3.合并配平法
关键是找出发生氧化还原反应的两种物质间的某种数量关系,常用方法有:
(1)通过某种物质的分子中原子间的数量关系,确定其他两种(或多种)物质的数量关系。
(2)通过电荷守恒等方法确定其他两种(或多种)物质的数量关系。
4.拆分配平法
适合氧化剂和还原剂是同一种物质,且氧化产物和还原产物也是同一种物质的化学方程式的配平,其配平技巧是将氧化还原剂(或氧化还原产物)根据需要进行合理拆分。
●歼灭难点训练
1.(★★★)配平下列化学方程式
(1)______Ca(ClO)2+______HCl![]() ______CaCl2+______Cl2↑+______H2O
______CaCl2+______Cl2↑+______H2O
(2)______H2S+______H2SO4![]() ______S↓+______SO2↑+______H2O
______S↓+______SO2↑+______H2O
2.(★★★★)配平下列氧化还原方程式
(1)_____H2PO![]() +_____Ag+_____H2O
+_____Ag+_____H2O![]() H3PO4+______Ag↓+______H2↑
H3PO4+______Ag↓+______H2↑
(2)____P4+____CuSO4+_______![]() ____Cu3P↓+_____H3PO4+_____H2SO4
____Cu3P↓+_____H3PO4+_____H2SO4
(3)____Na2Sx+____NaClO+_____NaOH![]() _____Na2SO4+____NaCl+____H2O
_____Na2SO4+____NaCl+____H2O
(4)____PH4ClO4![]() ____PCl5+____P2O5+____H2O
____PCl5+____P2O5+____H2O
3.(★★★★)在热的稀硫酸中溶解了11.4 g硫酸铁,当加入50 mL 0.50 mol·L-1硝酸钾溶液时,其中的亚铁离子完全转化为铁离子,并有氮氧化物逸出:
____FeSO4+___KNO3+ _____![]() ___K2SO4+___Fe2(SO4)3+___NxOy↑+___H2O
___K2SO4+___Fe2(SO4)3+___NxOy↑+___H2O
(1)配平该化学方程式(将含x、y的计量数和所缺物质填在横线上)
(2)反应中起氧化作用的物质是________(写化学式)
(3)推算出x、y的数值:x=________,y=________。
4.(★★★★★)三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的氮氧化物(如NO2)。当加热至一定温度时,它发生如下分解:
C3N3(OH)3![]() 3HNCO
3HNCO
产物HNCO(异氰酸,其结构H—N==C==O)能与NO2反应生成N2、CO2和H2O。
(1)写出HNCO与NO2反应的化学方程式:________。
(2)写出氧化产物与还原产物的质量之比________。
(3)要消除1.0 kg NO2需三聚氰酸[C3N3(OH)3]多少千克?
附:参考答案
难点磁场
1.3 5 2 H2O 3 5
歼灭难点训练
1.(1)1 4 1 2 2 (2)1 1 1 1 2
2.(1)合并配平法:由于生成物中无离子,根据电荷守恒的原则可知,反应物H2PO![]() 和Ag+的化学计量数应相等,所以,可将H2PO
和Ag+的化学计量数应相等,所以,可将H2PO![]() 和Ag+合并为一个整体“H2PO
和Ag+合并为一个整体“H2PO![]() +Ag+”,再进行配平。
+Ag+”,再进行配平。
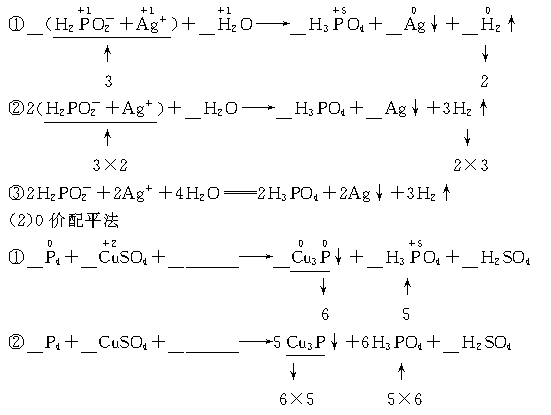 ③11/4P4+15CuSO4+
③11/4P4+15CuSO4+ ![]() 5Cu3P↓+6H3PO4+15H2SO4
5Cu3P↓+6H3PO4+15H2SO4
④11P4+60CuSO4+ ![]() 20Cu3P↓+24H3PO4+60H2SO4
20Cu3P↓+24H3PO4+60H2SO4
⑤11P4+60CuSO4+96H2O====20Cu3P↓+24H3PO4+60H2SO4
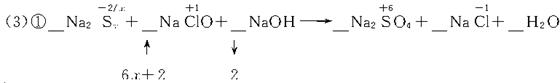 ②Na2Sx+(3x+1)NaClO+ NaOH
②Na2Sx+(3x+1)NaClO+ NaOH![]() Na2SO4+ NaCl+ H2O
Na2SO4+ NaCl+ H2O
↑ ↓
(6x+2)×1 2×(3x+1)
③Na2Sx+(3x+1)NaClO+(2x-2)NaOH====xNa2SO4+(3x+1)NaCl+(x-1)H2O
(4)将PH4ClO4拆分为PH![]() 和ClO
和ClO![]() ,然后进行配平。
,然后进行配平。
答案:(1)2 2 4 2 2 3
(2)11 60 96H2O 20 24 60
(3)1 3x+1 2x-2 x 3x+1 x-1
(4)5 1 2 10
3.提示:(1)由于反应在硫酸溶液中进行,因此可知所缺物质为H2SO4或H2O;由题给反应知H2O为生成物,故所缺物质为H2SO4。
n(FeSO4)=0.0750 mol,n(KNO3)=0.025 mol
则n(FeSO4)∶n(KNO3)=3∶1,![]() (FeSO4)∶
(FeSO4)∶![]() (KNO3)=3∶1
(KNO3)=3∶1
①3FeSO4+1KNO3+ H2SO4![]() K2SO4+ Fe2(SO4)3+ NxOy↑+ H2O
K2SO4+ Fe2(SO4)3+ NxOy↑+ H2O
②6FeSO4+2KNO3+4H2SO4====K2SO4+3Fe2(SO4)3+2/xNxOy↑+4H2O
(3)方法1:由方程式②,根据氧原子守恒得:24+6+16=4+36+2y/x+4
解得:y=x,则:NxOy为NO,即:x=1,y=1
方法2:设生成物NxOy中N元素的化合价为a,由上面方程式②得:
6×1=2×(5-a) a=2
则:NxOy为NO,即:x=1,y=1
方法3:设生成物NxOy中N元素的化合价为a,由题意得:
11.4 g÷152 g·mol-1×1=0.050 L×0.05 mol·L-1×(5-a)(化合价升降总值相等)
余略。
答案:(1)6 2 4H2SO4 1 3 2/x 4
(2)HNO3(答NO![]() 或KNO3亦可)
或KNO3亦可)
(3)1 1
4.提示:(1)根据异氰酸的结构式,先标出异氰酸中各元素的价态:
![]()
再分析生成物质:异氰酸(HNCO)中N元素-3价,NO2中N元素+4价,二者将发生歧化反应生成N2,HNCO和NO2中C、H、O三元素反应前都呈稳定价态,故不参加氧化还原反应,反应后仍呈稳定价态,他们可组成的稳定化合物只能是CO2和H2O:
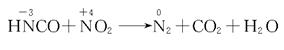
配平可得答案。
答案:(1)8HNCO+6NO2====7N2+8CO2+4H2O (2)4∶3 (3)1.2 kg