高三化学开放型化学试题
开放型化学试题,答案往往不惟一,或者条件过剩,或者条件缺乏,都具有一定难度。
●难点磁场
请试做下列题目,然后自我界定学习本篇是否需要。
将Fe、Cu、FeCl3、CuCl2四种固体放在烧杯中,加入适量水,搅拌,完全反应后溶液中仍存在Cu2+,则还可能存在的物质有:
| ① | ② | ③ | ④ |
(可不填满,也可补充)。
●案例探究
[例题]计算以下两小题时,除必须应用所有给出的数据外,还各缺少一个数据,指出该数据的名称(分别以a和b表示),并列出计算式。
(1)在温度为t℃和压强为p Pa的情况下,19.5 g A与11.0 g B恰好完全反应,生成固体C和3.00 L的D气体,计算生成的C的质量(m)。
缺少的数据是:____________,计算式为:m=____________。
(2)0.48 g金属镁与10 mL盐酸反应,计算生成的H2在标准状况下的体积[V(H2)]。
缺少的数据是:____________,计算式为:____________。
命题意图:考查学生对缺少条件的判定及补充条件后的计算能力。
知识依托:质量守恒定律、根据化学方程式的计算。
错解分析:忽视题干条件,补充出2个数据而出错;忽视气体的密度与温度等条件的关系,补充数据不补充数据存在的条件而出错;忽视所求V(H2)并不一定是在标准状况之下,补充出n(H2)而出错。与题意不符。
解题思路:本题就解题内容而言是两个较简单的题目,它采用了新的设问方法,每小题给出的信息中都缺少一个数据,要求考生先找出缺少的数据,再列式计算。为了防止答案过于分散,作了两项限制:①只准补充一个数据;②必须用到其他所有已知的条件。这样,可以避免考生将已知条件弃之不顾,而另外再设立若干条件,从而违背原题的立意。
第(1)小题给出反应物A和B的质量,以及气体产物D的体积,要计计算产物C的质量。由于该反应不涉及具体物质,因而不可能从反应物和产物的物质的量和摩尔质量来计算,只能从反应前后总质量相等着手。反应物的质量是已知的,而对产物D,则只知道其体积,要求算它的质量,必须知道该温度(t℃)和压强(p Pa)下气体的密度。将D的体积乘以该密度即得D的质量。
m(C)=m(A)+m(B)-m(D)。
第(2)小题要求计算反应中生成的H2在标准状况下的体积。题中给出了金属镁的质量和盐酸的体积,可是仅有盐酸的体积是无法确定其中HCl的质量或物质的量的,必须同时知道它的浓度(b mol·L-1)才行。
然而,即使补充了浓度,已知条件已经齐备,但是要计算生成H2的体积,还需要先判定Mg和HCl何者过量。
若HCl过量:
![]() ≥
≥![]()
则生成H2的体积应根据镁的量按下式计算:
V(H2)=![]() ×22.4 L·mol-1
×22.4 L·mol-1
若金属Mg过量:
![]() >
>![]()
则生成H2的体积应根据HCl的量按下式计算:
V(H2)=![]() ×22.4 L·mol-1
×22.4 L·mol-1
答案:(1)在t℃和p Pa下的气体密度(a)
m(C)=19.5 g+11.0 g-3.00 L×a[或m(C)=30.5 g-3.00a L]
(2)盐酸的物质的量浓度(b mol·L-1)
V(H2)=![]() ×22.4 L·mol-1或V(H2)=
×22.4 L·mol-1或V(H2)=![]() ×22.4L·mol-1
×22.4L·mol-1
●锦囊妙计
开放型化学试题包含以下几种情形:
1.条件过剩型:注意去伪存真,排除“假信息”的干扰,凸现“真信息”的作用。
2.条件不足型:要注意补充条件的准确性和严密性。
3.答案不惟一型:要注意思维的严密性,运用思维的序列性,谨防遗漏答案。
●歼灭难点训练
1.(★★★)现有含主族金属元素An+的溶液,c(An+)=0.80 mol·L-1。取该溶液10
mL恰好把20 mL 0.40 mol·L-1的Na2CO3(aq)中的CO![]() 全部沉淀。已知上述10 mL溶液中含此金属阳离子0.32 g,则该金属的相对原子质量为
全部沉淀。已知上述10 mL溶液中含此金属阳离子0.32 g,则该金属的相对原子质量为
A.24 B.32 C.40 D.64
2.(★★★★)在等物质的量短周期金属元素单质A和B中,分别加入足量的酸,在A中加入盐酸,在B中加入稀硫酸,反应完全后,生成氢气的体积分别为V(A)和V(B),而且V(A)≠V(B)。若要确定反应生成物中A和B的化合价,至少还需要知道的数据是
A.V(A)∶V(B)的值 B.V(A)[或V(B)]的值
C.A(或B)的物质的量 D.盐酸和硫酸的物质的量浓度
3.(★★★★)试设计实验证明两瓶颜色相近的气体哪一瓶是Br2蒸气,哪一瓶是NO2气体。(表可不填满,也可自行增加)
| 编号 | 方法和结论 |
| ① | |
| ② | |
| ③ |
4.(★★★★★)现有一份CuO和Cu2O混合物,用H2还原法测定其中CuO的质量x(g)。实验中可以测定如下数据:W—混合物的质量(g),W(H2O)—生成H2O的质量(g)、W(Cu)—生成Cu的质量(g)、V(H2)—消耗的H2在标准状况下的体积(L)。(已知摩尔质量:Cu2O—144 g·mol-1、H2O—18 g·mol-1、Cu—64 g·mol-1、CuO—80 g·mol-1)
(1)为了计算x,至少需要测定上述四个数据中的_______个,这几个数据的组合共有_______种,请将这些组合一一填入下表空格中。[说明:①选用W、W(H2O)、W(Cu)、V(H2)表示,不必列出具体计算式。②每个空格中填一种组合,有几种组合就填几种,不必填满]
(2)从上述组合中选写一个含W的求x的计算式:x=__________________。
附:参考答案
难点磁场
提示:先后发生下列3个反应:
①2Fe3++Fe====3Fe2+
②2Fe3++Cu====2Fe2++Cu2+
③Fe+Cu2+====Fe2++Cu
反应可分以下几种情况讨论:(1)恰好完全反应;(2)Fe2+有剩余;(3)Fe剩余;(4)Cu剩余。
答案:①Fe2+ ②Fe2+、Cu ③Fe2+、Fe3+
歼灭难点训练
1.提示:排出20 mL和0.40 mol·L-1等数据的干扰,可列出下式:
![]() =40 g·mol-1
=40 g·mol-1
答案:C
2.解析:在元素周期表中,短周期元素的金属单质在金属活动表中都排在氢之前,因而它们与盐酸、稀硫酸都可以发生置换反应。由于所用的酸都是过量的,因此用什么酸以及所用酸的浓度大小无关紧要,这样,首先排除选项D。
金属单质与过量酸进行置换反应,当金属的物质的量相同时,金属元素的化合价不同,生成氢气的体积也不同。这种判断是解决本题的关键。
由上述判断可知,只要知道了V(A)与V(B)之比,就可以知道两种金属元素的化合价。这是因为,若m、n分别为A、B化合价时,下式可成立:
![]()
由于A、B两元素的化合价只可能是+1、+2或+3,知道了它们的化合价之比,即能确定出它们的化合价。
答案:A
3.提示:根据Br2、NO2的性质思考答案。
答案:①分别加入蒸馏水振荡,溶液变为橙色者,原气体为Br2蒸气;气体颜色褪去但溶液为无色者,原气体为NO2。
②加入HNO3酸化的AgNO3(aq),生成浅黄色沉淀者,原气体为Br2蒸气,否则为NO2气体。
③将气体吸入针筒加压,气体颜色先变深后又稍变浅者,原气体为NO2;气体颜色只变深者为Br2蒸气。
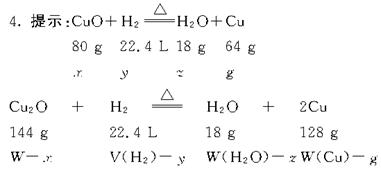
|

其余所有组合都可求出x。
答案:(1)2 5
 注意:在答案中只要出现V(H2)、W(H2O)这一错误组合,不论其他组合答对几种,一律不对。
注意:在答案中只要出现V(H2)、W(H2O)这一错误组合,不论其他组合答对几种,一律不对。
![]()