高三化学考前讲话(一)——物质结构
1.“—OH”化学上称为羟基,上个世经60年代美国化学家鲍林提出一个经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基氧原子数。鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)有如下关系:
| m-n | 0 | 1 | 2 | 3 |
| 酸的强弱 | 弱 酸 | 中 强 | 强 | 很 强 |
| 实 例 | HClO | H3PO4 | HNO3 | HClO4 |
(1) 按此规则判断H3AsO4、H2CrO4、HMnO4酸性由强到弱的顺序为_________________________________________。
(2) H3PO3和H3AsO3的分子组成相似,但酸性强弱相差很大,已知H3PO3为中强酸,H3AsO3为弱酸。试推断有关酸的结构式H3PO3_____________ H3AsO3_____________。
2.在同期表中,同一主族元素化学性质相似。目前已发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧,除生成 外,也生成微量的 。
(2)铍的最高价氧化物对应的水化物的化学式是 ,属两性化合物,证明
这一结论的有关离子方程为 、 。
(3)若已知反应Be2C+4H2O=2Be(OH)2+CH4↑,则Al4C3遇强碱溶液反应的离子方程式为
。
(4)科学家证实,BeCl2属共价化合物,设计一个简单实验证明,其方法是
。用电子式表示BeCl2的形成过程: 。
3.(1)1919年,Langmjuir提出等电子原理:原子数相同、电子数相同的分子,互称为等电子体,等电子体的结构相似、物理性质相近,化学性质有一定的相似性。
①化学家常用等电子体原理来预测不同物质的结构,例如CH4与NH4+有相同的电子数
及空间结构,依据此有所理,在下列括号中填出相应的化学式:
CH4 ( ) CO32-( ) C2O42-( )
NH4+ N2H62+( ) NO2-( ) N2
②过量的Mg在N2O中燃烧,写出反应的化学方程式 .
③仅由3~18号元素组成的共价分子中,互为等电子体的是: 和 ;
和 。
(2)此后,等电子原理又有所发展,例如,由1~18号元素组成的微粒,只要其原子数
相同,各原子最外层电子数之和相同,也要互称为等电子体,它们也具有相似的结
构特征,在短周期元素组成的物质中,与NO2-互为等电子体的分子有:
![]()
![]() 。
。
4.(1)BN是一种新型的无机材料,由于 与 属等电子体物质,其结构和性质
具有极大的相似性,则可推知,在BN的两种晶体中,一种是类似 的空间网状
结构晶体,可用作耐磨材料;另一种是类似于 的层状结构的混合型晶体,可用
作润滑材料,在其结构的每一层最小的封闭环中有 个B原子,B—N键键角
为 。各层状结构中有n个硼原子,则有______个六元环。
(2)单质硼有无定形和晶体两种,参考下表数据
| 晶体 | 金刚石 | 晶体硅 | 晶体硼 |
| 熔点/K | 3823 | 1683 | 2573 |
| 沸点/K | 5100 | 2628 | 2823 |
| 硬度/Mob | 10 | 7.0 | 9.5 |
 ①
晶体硼的晶体类型属于
晶体,理由是
。
①
晶体硼的晶体类型属于
晶体,理由是
。
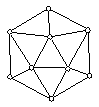
② 已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如
图所示),其中有20个等边三角形的面和一定数目的顶点,每
个顶点上各有1个硼原子,通过观察图形及推算,此基本结构
单元由 个硼原子构成,其中B—B键的键角为 。
(3)假设将晶体硼结构单元中每个顶角均削去,余下部分的结构与C60
相同,则C60由 个正五边形和 个正六边形构成。
5.电离能是指1 mol气态原子(或阳离子)失去1 mol电子形成1 mol气态阳离子(或更高价态阳离子)所需吸收的能量。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸收力; B.形成稳定结构的倾向
如,3号元素锂的电离能I1~I3依次为:
I1=5.39、I2=75.64、I3=122.5。
现有核电荷数小于20的元素A,其电离能数据如表所示(I1表示原子失去第1个电子的电离能,In表示原子失去第n个电子的电离能(单位:kJ/mol)
| 序 号 | I1 | I2 | I3 | I4 | I5 | I6 |
| 电离能 | 7.65 | 15.04 | 80.14 | 109.2 | 141.2 | 186.5 |
| 序 号 | I7 | I8 | I9 | I10 | I11 | …… |
| 电离能 | 224.9 | 265.9 | 327.9 | 367.5 | 1761 | …… |
试根据以上信息回答:
(1)为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的
能量______________。
(2)外层电子离核越远,能量越高,电离能越 (填“大”或“小”);阳离子电
荷数越高,再失去电子时,电离能越 (填“大”或“小”)。
(3)上述11电子分属几个电子层? 。
(4)去掉11个电子后,该元素还有 个电子。
(5)该元素最高价氧化物对应水化物的化学式是 。
6.1919年,Langmuir提出:原子数相、电子数相同的分子,互称为等电子体。后来扩展为“等电子原理”,即等电子体的结构相似、物理性质相近。该原理常被用于发现或者合成具有特殊功能的晶体和有机物等诸多领域。X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
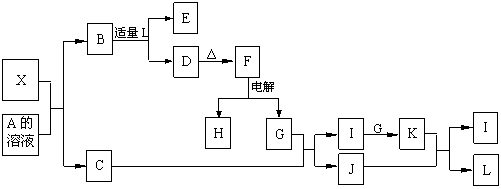
其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体;D为白色沉淀且既溶于强酸又溶于强碱溶液;E溶液的焰色反应呈黄色。回答以下问题:
(1)写出X的化学式:____________,X属于__________晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:_____________________________________。
写出K与J反应的化学方程式:_____________________________________。
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(横线上填新物质的化学式)。
+2N2![]() 4X+SiC+3C。
4X+SiC+3C。
7.PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,
在水中的溶解度较大。请回答下列问题:
(1)PtCl2(NH3)2是平面正方形结构还是四面体结构? 。
(2)请在以下空格内画出这两种固体分子的几何构型图:
淡黄色固体: ,黄绿色固体: 。
(3)淡黄色固体物质是由 组成的,黄绿色固体物质是由 组成
的。(填“极性分子”或“非极性分子)
(4)黄绿色固体在水中溶解度比淡黄色固体大,原因是 。
8.现有下列短周期元素性质的有关数据:
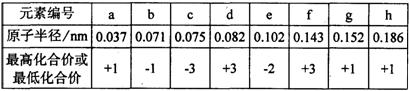 |
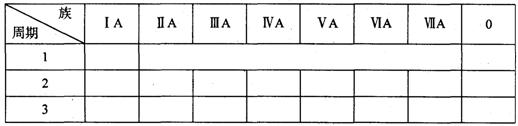
(1)根据元素周期律确定a~h 8种元素在周期表中的位置,将它们的元素编号填入下表相
应的空格内。
 |
(2)上述元素形成的氢化物中,分子间存在氢键的有(填氢化物的化学式)_________。
(3)氢化铝锂(LiAlH4)是一种易燃易爆具有极强还原性的物质,它在有机合成上应用
广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。
①氢化铝锂易水解,最初得三种产物,请写出其水解反应方程式:
___________________________________________________。
②与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请将这种还
原剂的电子式填在横线上 。写出该物质受热分解
的反应方程式:__________________________________________。
(4)原子数相同,电子总数相同的分子或离子互称等电子体。
在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白
石墨”和石墨具有等电子体特征,请写出“白石墨”的最小结构单元的结构式:_____
________________。
9.PCl5是一种白色固体,加热到160℃不经过液态阶段就变成蒸气,测得180℃下的蒸气密度(折合成标准状况)为9.3g/L,极性为零,P—Cl键长为204pm和211pm两种。继续加热到250℃时测得压力为计算值的两倍。PCl5在加压下于148℃液化,形成一种能导电的熔体,测得P—Cl的键长为198pm和206pm两种。(P、Cl相对原子质量为31.0、35.5)回答如下问题:
(1) 180℃下PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。
(2) 在250℃下PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。
(3) PCl5熔体为什么能导电?用最简洁的方式作出解释。
(4)PBr5气态分子结构与PCl5相似,它的熔体也能导电,但经测定其中只存在一种P-Br
键长。PBr5熔体为什么导电?用最简洁的形式作出解释。