高三化学考前讲话四——综合实验
|
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
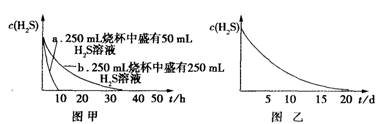 实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1-2天未见浑浊现象。用相同浓度的碘水去滴定氢
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1-2天未见浑浊现象。用相同浓度的碘水去滴定氢
硫酸溶液测其浓度。图甲所示为两只
烧杯中氢硫酸浓度随时间变化而减小
的情况。
实验二:密闭存放的氢硫酸,每天
定时取1 mL氢硫酸,用相同浓度的碘
|
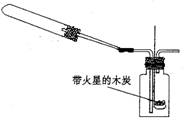
实验三:如图丙在饱和氢硫酸溶液中以极慢
的速度通入空气(1—2个气泡/min),数小时未见变浑浊的现象。
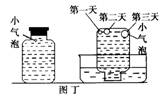
实验四:如图丁密闭存放的盛满饱和氢硫酸溶液的试剂瓶,隔2-3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2~3天,
在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的的增加,这种
气泡也略有增多(大),浑浊现象更明显些。
请回答下列问题:
|
(2)实验—和实验二中,碘水与氢硫酸反应的化学方程式
为_______________。两个实验中准确判断碘水与氢硫酸恰好完
全反应是实验成功的关键。请设计实验方案,使实验者准确掌握
所加碘水恰好与氢硫酸完全反应。_________________________。
(3)“氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生
成了________的缘故。
(4)该研究性学习小组设汁实验三说明他们认为“氢硫酸长期存放会变浑浊”的假没原因之一是(用文字说明)_______________________。此实验中通人空气的速度很慢的主要原因是什么?______________________________________。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是______________。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?_________________________。
 2.某实验小组的同学探究氢氧化铜的制法。实验记录为
2.某实验小组的同学探究氢氧化铜的制法。实验记录为
(1)同学们猜想3、4号试管中沉淀为Cu(OH)2, 1、2号试管中沉淀为Cu2(OH)2SO4。试写生成Cu2(OH)2SO4的离子方程式 。
![]() 实验:
实验:
操作I名称__________,需要的玻璃仪器有________________,如何操作才能保证最后白色沉淀中SO42-来自绿色固体_____________。
3.某化学研究性学习小组在研究KClO3制取氧气实验时查得如下资料:
资料一:KClO3单独加热到3630C时熔融,在3800C时发生两个反应:
①4KClO3=3KClO4+KCl ②2KClO3=2KCl+3O2↑
加热至4000C以上时KClO4又发生分解,放出大量的O2。
资料二:若用MnO2作催化剂,则KClO3在2000C时就能迅速分解,但制得的氧气中有氯气的气味,生成的氯化钾又略带紫红色,反应过程如下:
③2KClO3+2MnO2=2KMnO4+Cl2↑+O2↑ ④2KMnO4=K2MnO4+MnO2+O2↑
⑤Cl2+K2MnO4=2KCl+MnO2+O2↑
资料三:部分物质的物理性质
| 物质 颜色的状态 | 密度/g·cm3 | 00C时溶解度/g | 1000C时溶解度/g |
| KCl 无色晶体 | 1.98 | 27.6 | 56.7 |
| KClO3 无色晶体 | 2.32 | 3.3 | 57 |
| KClO4 无色晶体 | 2.52 | 0.75 | 21.8 |
(1)在KClO3与KClO4中,热稳定性较好的是___________。
(2)单独加热KClO3制取氧气时,试管口应稍向 (填“上”或“下”)倾斜,证明生成物中有KCl的方法是:_________________。假设资料一中只发生反应①,则证明有KClO4生成的实验方法是______________________________。
(3)若用MnO2作催化剂制取氧气时,反应③中氧化产物是______(填化学式),按该反应过程,若制取1.5molO2,总共有______mol电子发生转移。
(4)若用MnO2作催化剂加热KClO3时,两者质量比以MnO2占1/3为最好。若用占1/10的MnO2和KClO3共热时,开始放出氧气较慢,继续加热至一定温度时,放出氧气的速率会很快,其主要原因可能是___________________________。
4.中学教材上有如下介绍:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计方案的流程如下:
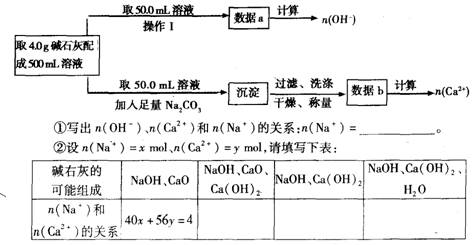
(2)第二小组同学查得如下资料:Ca(OH)2在250℃时不分解、NaOH在580℃时不分解。他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在2500C时加热至恒重,测得固体质量减少了0.6g,剩余固体在5800C时继续加热至恒重,固体质量又减少了0.7g。请经过计算确定该碱石灰各成分的质量分数。
5.某校化学兴趣小组的同学在进行研究性学习时,对“NO2能否支持燃烧”这个问题很感兴趣,他们决定自己动手设计实验进行探究。
(1)甲组同学设计的实验方案:向烧瓶中加入适量浓硝酸并加热,当烧瓶中有红棕色气体产生之后,将燃着的木条伸人烧瓶中,发现木条火焰熄灭。由此他们得出“NO2不能支持燃烧”的结论。
甲组同学所得的结论正确吗?请你说明理由:_____________________________ _________________________。
|
如:2Cu(NO3)2 2 CuO+4NO2↑,
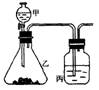
2AgNO32Ag+2NO2↑+O2↑。他们根据此原理设计了
如右图所示的实验装置(加热、夹持仪器未画出),并分别用
Cu(NO3)2和AgNO3进行实验,实验中发现当红棕色气体进入
集气瓶后,带火星的木炭均能复燃,乙组同学由此得出“NO2能支持燃烧”的结论。
①老师认为上述两个实验中,有一个实验所得结论是不可靠的,你认为该实验中选用的反应物是__________,其结论不可靠的原因是_________________.
②运用该实验装置进行实验时,造成的不良后果是______________________________
_______________。
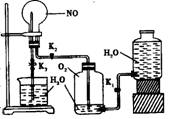
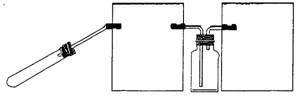 (3)丙组同学拟设计一个用较为纯净的NO2气体(无O2产生)来探究“NO2能否支持燃烧”的实验。
(3)丙组同学拟设计一个用较为纯净的NO2气体(无O2产生)来探究“NO2能否支持燃烧”的实验。
①丙组同学制取NO2的化学方程式是
_______________。
②右图是该组同学设计的制取并收集
NO2气体的实验装置,请在方框中将该装
置补充完整,并注明补充装置中所用试剂。
|
必须善于掌握这些规律,这样有利于我们对零散的知识理解和记忆。在我
们的课本或课堂中出现的几率最多的是右图的装置,它是由物质制备和检
验生成物性质两部分组成的,(暂不考虑除杂,尾气的吸收)。请你选用中
学化学常见试剂设计两个实验,将所用试剂名称、丙中现象及由此得出的
实验结论(可以是单一物质的性质,也可以是不同物质性质比较)填入下列空白处:
(1)[实验一]
所用试剂:甲___________、乙___________、丙___________;
丙中现象 ;
实验结论 。
(2)[实验二]:甲___________、乙___________、丙___________;
丙中现象 ;
实验结论 。
7.某学生设计了一套验证物质化学性质的实验装置(如下图):请完成下列问题:
|
(2)该实验的原理是(用化学方程式表示)
。
(3)检查本装置气密性的最好方法是 。
(5)实验步骤:①按图连接好仪器装置;②打开活塞K1和
K2,主要现象为____________;③关闭活塞K1和K2,打开止水
夹K3,要使烧瓶内产生喷泉,可采用的方法是 。
8.亚硝酸钠NaNO2可用作水泥施工的抗冻剂。它易溶于水,有碱性,有氧化性,也有还原性。在酸性溶液中它能氧化碘离子、亚铁离子。它能将人体内血红蛋白里所含的亚铁离子氧化为三价铁离子使人中毒,在建筑工地上多次发生把亚硝酸钠误作食盐使用,导致民工中毒的事件。亚硝酸钠和酸反应产生亚硝酸,亚硝酸是不稳定的弱酸,它只存于冷的稀溶液中,易发生分解反应:3HNO3=2NO↑+HNO3+H2O。
从醋酸、氨水、纯碱、稀盐酸、碘化钾-淀粉溶液中选择适当的物质做试剂,用两种简单的化学实验方法来鉴别亚硝酸钠和氯化钠。
方法一:试剂是(只用一种试剂);现象: 。
方法二:实验步骤及实验现象是 。