高三化学第二轮总复习阶段检测
化 学 试 题
共100分,时间90分钟。
第一卷(选择题,共36分)
(每题3分)
1.某溶液能使红色的石蕊试纸先变蓝色后褪色,则该溶液中可能大量共存的离子组是
A.K+、I-、AlO2-、HCO3-、MnO4- B.Na+、S2- 、NO3-、SO32-、SO42-
C.Fe2+、Al3+、NH4+、NO3-、F- D.K+、Na+、Cl-、ClO-、CO32-
2.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1︰16,则x值是
A.2 B.3 C.4 D.5
3.设NA表示阿伏加得罗常数,下列叙述正确的是
A.标准状况下,11.2L氦气所含的原子数为NA
B.1.6gNH2-离子中所含的电子数为NA
C.常温常压下,44g二氧化碳分子中所形成的共用电子对数为2NA
D.NA个氮分子和NA个氢分子的体积比是1︰1
4.2005年12月1日为世界第18个艾滋病日,截至2005年9月底,全国累计报告艾滋病病毒感染者超过13万。医学界通过放射性14C标记的C60,发现C60的羧酸衍生物在特定条件下可断裂DNA杀死细胞,抑制艾滋病。关于14C的下列说法中正确的是
A.14C原子与C60中普通碳原子的化学性质不同
B. 14C原子与14N原子所含中子数相同
C.与12C、13C是碳元素的三种同位素
D.是C60的同素异形体
5.取0.2mol·L-1HX溶液与0.2mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH = 8,则下列说法(或关系式)不正确的是
A.混合溶液中由水电离出的c(OH¯)>0.2mol·L-1HX溶液中由水电离出的c(H+)
B.c(Na+) = c(X¯) + c(HX) = 0.2mol·L-1
C.c(Na+)-c(X¯) = 9.9×10-7mol·L-1
 D.c(OH¯)-c(HX) = c(H+) = 1×10-8mol·L-1
D.c(OH¯)-c(HX) = c(H+) = 1×10-8mol·L-1
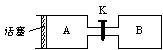
6.右图A、B是等体积容器,K是开关,活塞可以左右移动。在一定温度下,关闭K,向A中通入一定量的NO2。发生:2NO2(g)![]() N2O4(g);△H<0。则以下说法正确的是
N2O4(g);△H<0。则以下说法正确的是
A.保持活塞位置不变,打开K,体系中气体颜色先变浅、然后略加深
B.打开K一会,再关闭它,向右推动活塞时,最后A容器的气体颜色比B的浅
C.打开K一会,再关闭它,把A容器加热,活塞向右移动,A中气体颜色变浅
D.打开K一会,再关闭它,向B中通入氩气,B中气体颜色变浅
7.下图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr。下列说法正确的是
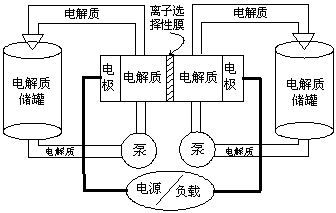
A.电池充电时,阳极电极反应式为:3Br-2e-=Br3-
B.电池放电时,负极电极反应式为:2S22-+2e-==S42-
C.电池放电时,电池的总反应方程式为:Na2S4+3NaBr=2Na2S2+NaBr3
D.在放电过程中Na+通过膜的流向为从左到右
8.2005年4月22日是第36个“世界地球日”,我国国土资源部确定今年“世界地球日”的主题为“善待地球—科学发展,构建和谐”。你认为下列行为中不符合这一主题的是
A.开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料
B.控制含磷剂的生产和使用,防止水体富营养化,保护水资源
C.研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展
D.实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle)
9.将一定量的Fe、Fe2O3、CuO的混合物放入体积为100mL、浓度为2.2mol·L-1的H2SO4溶液中,充分反应后,生成气体896mL(标况),得到不溶固体1.28g,过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为100mL)。向滤液滴加2mol·L-1的NaOH溶液至40mL时开始出现沉淀。则未滴加NaOH溶液前滤液中FeSO4的物质的量浓度为:
A.2mol·L-1 B.1.8mol·L-1 C.1.9mol·L-1 D.无法计算
10.10月13日有关媒体报道天津巨能化学有限公司生产的巨能钙含有双氧水,经农业部产品质量监督检验测试中心检测,部分送检品种不同程度地含双氧水。双氧水属于危险化学品及有毒有害物质,以前也曾作为漂白剂、杀菌剂、防腐剂广泛用于食品中。下列有关H2O2的叙述中正确的是
A.H2O2是二元弱酸,将H2O2溶液滴入含有酚酞的NaOH溶液中,红色消失,一定是因为发生了酸碱中和反应
B.H2O2分子中含有非极性键,因此H2O2是非极性分子
C.H2O2的自然分解过程非常缓慢,一般不易察觉,但正因为如此,一般药用的双氧水在贮存期间也会逐渐失效
D.人体中含有过氧化氢酶,过氧化氢酶可以使H2O2分解,因此人体即使吸收多量的H2O2也没有关系,可以被过氧化氢酶分解为无毒物质
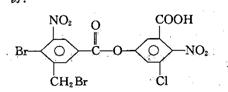 11.已知苯环上由于取代基的影响,使与硝基邻位上的卤原子的反应活性增强。1mol有机物:与足量的NaOH溶液混合,在一定的条件下反应共消耗NaOH物质的量为
11.已知苯环上由于取代基的影响,使与硝基邻位上的卤原子的反应活性增强。1mol有机物:与足量的NaOH溶液混合,在一定的条件下反应共消耗NaOH物质的量为
A.4mol B.6mol C.8mol D.10mol
12.氢是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如图所示。则这种合金的化学式:
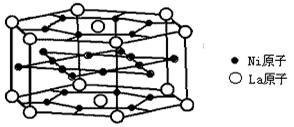
A.LaNi3 B.LaNi4 C.LaNi 5 D.LaNi6
第二卷(非选择题,共64分)
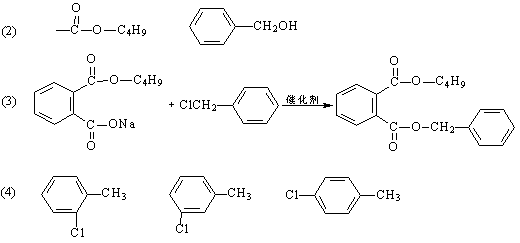
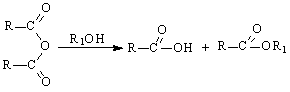 13.(16分)某有机物J(C19H20O4)不溶于水,毒性低,与聚氯乙烯、聚乙烯等树脂具有良好相容性,是塑料工业主要增塑剂,可以用下列方法合成。
13.(16分)某有机物J(C19H20O4)不溶于水,毒性低,与聚氯乙烯、聚乙烯等树脂具有良好相容性,是塑料工业主要增塑剂,可以用下列方法合成。
已知:
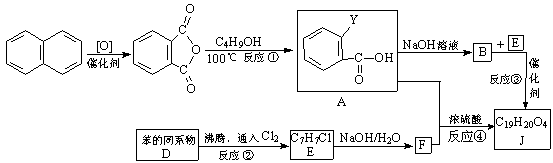
合成路线为:
上述流程中:(i)反应A→B仅发生中和反应,(ii)F与浓溴水混合不产生白色沉淀。
(1)指出反应类型:反应②____________________,反应④_____________________。
(2)写出结构简式:Y____________________________,F______________________。
(3)写出B+E→J的化学方程式:___________________________________________。
(4)写出E的属于芳香烃衍生物的同分异构体的结构简式:____________________、
____________________、____________________。
14.(20分)如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(氢硫酸)、C(碘化钾淀粉溶液)、D(水)、F(紫色石蕊试液)。
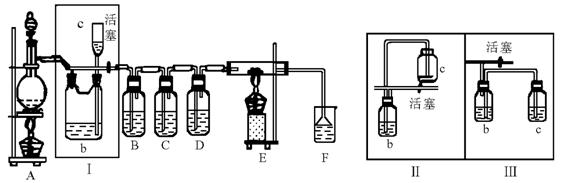
(1)A是氯气发生装置,其化学反应方程式可以是:__________________________________。
(2)Ⅰ中b瓶内宜加入的液体一般是____________。怎样检验这一部分装置的气密性_____
__________________________________。
(3)用图示的Ⅱ或Ⅲ代替Ⅰ是否可行?________。简要说明理由________________________
__________________________________。
(4)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①怎么证明氯气已充满了整个装置_______________________________________________。
②下列装置中的现象是B_____________________,C_____________________。
(5)E装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为二氧化碳和氯化氢,写出E中反应的化学方程式_______________________________________________。
(6)在F处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是_____________
____________________________________________________________________。
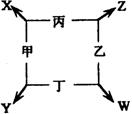 15.(14分)甲、乙、丙、丁四种单质在点燃的条件下反应生成X、Y、Z、W四种化合物,转化关系如右图所示。又知:①甲、乙、丙均为短周期元素的单质,常温下均为气态,丁是日常生活中的常见金属;②常温下,X是无色液体,Y是黑色固体;③丙在乙中燃烧发生苍白色火焰,丁在乙中燃烧生成棕色烟,W的水溶液呈黄色。
15.(14分)甲、乙、丙、丁四种单质在点燃的条件下反应生成X、Y、Z、W四种化合物,转化关系如右图所示。又知:①甲、乙、丙均为短周期元素的单质,常温下均为气态,丁是日常生活中的常见金属;②常温下,X是无色液体,Y是黑色固体;③丙在乙中燃烧发生苍白色火焰,丁在乙中燃烧生成棕色烟,W的水溶液呈黄色。
请填空:
(1)丁在甲和X同时存在的条件下,容易被腐蚀,写出电极反应式:
负极:__________________________ 正极:_________________________________
(2)将饱和W的溶液滴入到热的X中煮沸几分钟,反应的化学方程式为
__________________________________________________________________________。
(3)Y与足量的稀HNO3反应的离子方程式为:
__________________________________________________________________________。
(4)在一定条件下,丁分别Y、Z反应生成等物质的量的丙时,消耗丁的物质的量之比
为___________。
16.(14分)取A、B两份物质的量浓度相等的NaOH溶液,体积均为50mL,分别向其中通入一定量的CO2后,再分别稀释为100mL
⑴在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是:
①______________②_____________③_____________④_____________
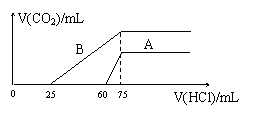 ⑵在稀释后的溶液中分别逐滴加入0.1mol/L的
⑵在稀释后的溶液中分别逐滴加入0.1mol/L的
盐酸,产生CO2的体积(标准状况)与所加盐
酸的体积关系如图所示:
①分别加入足量的盐酸后,溶液中的溶质是_______________,原NaOH溶液的物质的量浓度为__________________mol/L。
②A曲线表明,原溶液通入CO2后,所得溶质与HCl反应产生CO2的最大体积是_____________mL(标准状况)。
③B曲线表明,原溶液通入CO2后,所得溶质的化学式为____________,其物质的量之比为____________________。
非选择答案:
13.(1) 取代 酯化
14.(1)MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(2)饱和食盐水 关闭分液漏斗旋塞和Ⅰ处活塞,从c中向容器内加饱和食盐水,当c的下端浸入液面下且c中的液面高于b瓶内液面,并长时间不下降,则说明气密性好
(3)Ⅱ可行,Ⅲ不行 Ⅱ与Ⅰ原理相同,而Ⅲ中因c瓶口密封,体积不能改变,增大压强时会有危险
(4)①观察当整个装置内充满黄绿色气体时,说明氯气已充满整个装置。②有浅黄色沉淀生成 溶液变蓝
(5)C+2H2O+2Cl2
![]() CO2+4HCl
CO2+4HCl
(6)生成的HCl使紫色石蕊试液变红色,剩余的氯气又与水作用生成次氯酸,又起漂白作用,使红色褪去
15.![]()
![]()
![]()
(4)3:4(2分)
16.(14分)(1)①NaOH、Na2CO3②Na2CO3③Na2CO3、NaHCO3④NaHCO3(每空1分)
(2)①NaCl;a15(各2分)②33.6(2分)③Na2CO3和NaHCO3;1:1(各2分)