高三化学第三次月考试卷
可能用到的原子量:H =1 O = 32 N = 14 C =12 S=32 Na=23
P=31 Fe=56 Cl=35.5 Ca = 40
一选择题(每题只有一个正确选项,每题3分)
1、下列变化一定不包含化学变化的是: ( )
A、皂化反应后,加入食盐,使肥皂凝聚B、钢铁在潮湿的空气中生锈
C、纯碱在空气中风化 D、无水硫酸铜溶于水溶液呈蓝色
2、在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是 ( )
|
C、Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑D、NH4Cl+NaOH = NaCl+H2O+NH3↑
3、NA表示阿伏加德罗常数,以下说法正确的是 ( )
A、31g白磷含有P—P键的总数为6 NA
B、1.6gNH2-离子含有电子总数NA
C、1L 1mol·L-1 FeCl3溶液中含有Fe3+的数目为NA
D、标准状况下,22.4L的HC1气体溶于lL水中得到O.1mol/L的盐酸溶液
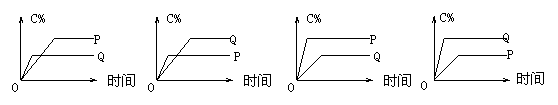
4、在A(g)+B(g)=C(g)+D(g)的反应体系中,C的百分含量和时间的关系如图所示,若反应分别在400℃和100℃下进行,所得曲线分别为Q与P,则正反应是放热反应的图为
5、下列离子方程式书写正确的是 ( )
A、烧碱溶液和过量Ca(HCO3)2溶液反应
Ca2++2OH-+2HCO3-=CaCO3↓+CO32- +2H2O
B、醋酸铅溶液中通入H2S气体 Pb2+ +H2S = PbS↓+2H+
![]() C、小苏打在溶液中的电离 HCO3- +H2O H3O+
+CO32-
C、小苏打在溶液中的电离 HCO3- +H2O H3O+
+CO32-
D、Cl2通入冷水中 Cl2 +H2O = 2H+ + Cl- + ClO-
6、已知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是( )
A、Al3+、CH3COO-、Cl- B、Mg2+、Br- 、Ba2+
C、Mg2+、Cl-、I- D、Na+、NH4+、Cl-
7、有一瓶无色气体,可能含有H2S、CO2、HBr、HCl、SO2中的一种或几种。向其中加入过量氯水,得到无色透明溶液,把溶液分成两份;向其中加入盐酸化的BaCl2溶液,出现白色沉淀;向另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀。则下列结论正确的是 ( )
A.原气体中可能有SO2
B.原气体中肯定有H2S和HBr
C.原气体中肯定有SO2和HCl
D.原气体中肯定没有CO2
8、下列各组溶液在只有水和试管的情况下,达不到鉴别目的的是 ( )
A.溴乙烷、乙醇、乙酸乙酯三种液体
B.Na2O2、CaCl2、CuSO4、硫磺四种固体
C.CaCO3、NaHSO4、CaC2、Mg(OH)2四种固体
D.NaCl、Na2SO4、AlCl3、Mg3N2四种固体
9、下列褪色过程不是因为氧化还原反应而褪色的是 ( )
A.SO2气体通入到溴水中使溴水褪色
B.氯水使滴有酚酞的NaOH溶液褪色,加入NaOH后不变红
C.乙二酸能洗去溅在布条上的蓝墨水
D.在含有碘单质的淀粉溶液中,加入KOH溶液后蓝色褪去
10、为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确,且最后能得到纯净物质的是 ( )
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 溴化钠溶液(NaI) | 氯水、CCl4 | 萃取、分液 |
| B | 氯化铵溶液(FeCl3) | 氢氧化钠溶液 | 过滤 |
| C | 二氧化碳(CO) | 氧化铜粉末 | 通过灼热的CuO粉末 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
11、 已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
实验室用铅蓄电池作电源,用惰性电极电解CuSO4溶液,当阴极析出2.4g铜时,铅蓄电池内消耗H2SO4物质的量至少是 ( )
A. 0.050mol B. 0.075mol
C. 0.20mol D. 0.40mol
12、下列说法中,正确的是 ( )
A. 周期表中的主族都有非金属元素
B. 周期表中的主族都有金属元素
C. 周期表中的非金属元素都位于主族
D. 周期表中的非金属元素都位于短周期
13.下列各组物质发生变化时,所克服的微粒间作用力属于同种类型的是( )
A.二氧化硅熔化、生石灰熔化 B.食盐熔化、蔗糖熔化
C.碘升华、干冰升华 D.钠变成蒸汽、硫变成蒸汽
14、下列与胶体性质无关的事实是 ( )
A. 电泳现象
B. 制药皂时常掺入少量苯酚
C.氯化镁可使血液很快凝固
D.一束光线照射蛋白质与水混合液时,从侧面可看到光亮的通路
15、已知:H+(aq)+OH-(aq)==H2O;△H1=-57·3kJmol-1,H2SO4(浓)+NaOH(aq)===Na2SO4(aq)+H2O(l):△H2=m,下列说法正确的是 ( )
A、上述热化学方程式中的计量数表示分子个数 B、△H1>△H2
C、△H2=-57.3kJ·mol-1 D、 △H1>△H2
16.下列各组内的两种物质的溶液具有相同的物质的量浓度,当逐滴加入时,前一种溶液滴入后一种溶液中与后一种溶液滴入前一种溶液中,,产生的现象相同的是( )
①HNO3和NaAlO2 ②NaOH和AlCl3 ③Ca(HCO3)2和Ca(OH)2 ④Na2CO3和盐酸 ⑤AgNO3和氨水 ⑥NaHCO3和盐酸
A.①⑤ B.②④ C.⑤⑥ D.③⑥
17.在反应11P+15CuSO4+24H2O = 5Cu3P +6H3PO4+15H2SO4中32g CuSO4能氧化磷的质量为
A、1.24g B、13.64g C、3.1g D、4.24g
二 填空题
18.(8 分)某化学反应的反应物和产物如下:
KMnO4 + KI + H2SO4 → MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是 。
(2)如果该反应方程式中I2和KIO3的系数都是5
① KMnO4的系数是 。
② 在下面的化学式上标出电子转移的方向和数目 :
KMnO4 + KI + H2SO4 →
(3)如果没有对该方程式中的某些系数作出限定,可能的配平系数有许多组。原因是
。
19.(10分)(1)X、Y、Z为三个不同短周期非金属元素的单质,在一定条件下有如下反应X+Y→A(g),Y+Z→B(g),请针对以下两种不同情况回答:
(a)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则①Y的化学式为 ,②生成C的电子式为 。
(b)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则
①B的化学式为 ,②向NaOH溶液中通入过量A,所发生反应的离子方程式为 。
(c)将Y和(a)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是
。
20、(8分)(1)观察如下反应,总结规律,然后完成下列问题:
![]()
![]() ①Al(OH)3+H2O Al(OH)4- +H+ ②NH3+H2O NH4++OH-
①Al(OH)3+H2O Al(OH)4- +H+ ②NH3+H2O NH4++OH-
(A)已知B(OH)3是一元弱酸,试写出其电离方程式
(B)已知N2H4是二元弱碱,试写出其二步电离方程式
。
(2)将a mol Cl2通入含 b mol FeBr2的溶液中,若0< ≤时,反应的离子方程式为2Fe2+ +Cl2 = 2Fe3+ +2 Cl-,写出另2个可能发生的离子方程式。
①当 < < 时 。
②当 ≥时 。
21、(8分)现有A、B两容器,A容器固定,B容器可变,一定温度下在A中加入2molN2和3molH2,反应达平衡时生成NH3的物质的量为m:
(1)相同温度下,在B中加入4mol N2和6molH2,当B中的压强和A的压强相等,B中达到平衡时,生成NH3的物质的量 2m(填大于、等于、小于),当B的容积和A的容积相等,B中达平衡时生成NH3的物质的量 2m(填大于、等于、小于)。
(2)相同温度下,保持B的容积是A容积的一半,并加入1 molNH3,要使B中反应达平衡时各物质的质量分数与上述A中达平衡时相同,则起始时应加入 mol N2和
mol H2。
22、(8分)(1)在25℃、101kPa下将15L O2通入10L CO和H2的混合气体中使其充分燃烧,干燥后恢复到原来温度和压强。
①若剩余气体的体积为15L,则原混合气体中![]() ,V(CO)=
。
,V(CO)=
。
②若剩余气体的体积为a L,则原混合气体中V(CO): ![]() ,且a的取值范围
,且a的取值范围
----------------
23.(8分)较低温度下,氯气通入石灰乳中可制得漂白粉,该反应为放热反应。某校甲、乙两化学研究性学习小组均用200 mL 12 mol / L盐酸与17.4 g MnO2在加热条件下反应制备氯气,并将制备的氯气与过量的石灰乳反应制取漂白粉,用稀氢氧化钠溶液吸收残余的氯气。分析实验结果发现:① 甲、乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值,② 甲组在较高温度下将氯气与过量的石灰乳反应,所制得的产品中Ca(ClO3)2的含量较高。试回答下列问题: (05江苏化学.25)
(1)上述实验中理论上最多可制得Ca(ClO)2多少克?
(2)实验中所得到的Ca(ClO)2的质量明显小于理论值,试简要分析其可能原因,并写出可能涉及到的化学方程式。
答 案
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| A | A | B | A | C | D | A | D | C |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |
| C | B | C | C | B | B | D | A |
二、填空题
18、(1)该反应的氧化剂是 KmnO4 。(2)① KMnO4的系数是 8
② 在下面的化学式上标出电子转移的方向和数目 :
![]()
![]()
![]() 40e-
40e-
KMnO4 + KI + H2SO4 →
(3) 因碘化钾、碘酸钾系数不定则不能确定失电子数
19、(a),则①Y的化学式为 H2 ,②生成C的电子式为 NH4Cl电子式略 。
(b)①B的化学式为 SO2 ,②向NaOH溶液中通入过量A,所发生反应的离子方
程式为 H2S + OH- = HS- + H2O 。
(c)将Y和(a)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式
S + 3Cl2 + 4H2O = H2SO4 + 6HCl 。
20、(A)电离方程式 B(OH)3 + H2O ≒ B(OH)4- + H+
(B)已知N2H4是二元弱碱,试写出其二步电离方程式 N2H5+ + H2O = N2H62+ + OH- 。
(2)①当 < < 时 2Cl2 + 2Fe2+ + 2Br-=4Cl-+2Fe3+ + Br2 (合理答案均给分) 。
②当 ≥时 3Cl2 + 2Fe2+ + 4Br-=6Cl-+2Fe3+ + 2Br2 。
21、(8分)(1)生成NH3的物质的量 等于 2m(填大于、等于、小于),
B中达平衡时生成NH3的物质的量 大于 2m(填大于、等于、小于)。
(2)则起始时应加入 0。5 mol N2和 0 mol H2。
22、(1)①若剩余气体的体积为15L,则原混合气体中![]() 5 L ,V(CO)= 5 L 。
5 L ,V(CO)= 5 L 。
②若剩余气体的体积为a L,则原混合气体中V(CO): ![]() a-10/20-a ,且a的取值范围 10<a<20
a-10/20-a ,且a的取值范围 10<a<20
23、(1)上述实验中理论上最多可制得Ca(ClO)2 14。3 克?
(2)试简要分析其可能原因,并写出可能涉及到的化学方程式。
该反应为放热反应,随温度的升高发生反应6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H20
Cl2 不能被完全吸收,一部分被氢氧化钠吸收:Cl2+2NaOH=NaCl+NaClO+H20