高三化学第三章 物质的量
1.(94全国,12)设NA代表阿佛加德罗常数,下列说法正确的是 D
A.2.4 g 金属镁变成镁离子时失去的电子数目为0.1NA
B.2克氢气所含原子数目为NA
C.在25℃,压强为1.01×105帕时,11.2升氮气所含的原子数目为NA
D.17克氨气所含电子数目为10NA
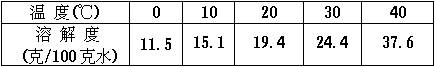 |
2.(94全国,20)已知某盐在不同温度下的溶解度如右表.若把质量百分比浓度为22%的该盐溶液由50℃逐渐冷却,则开始析出晶体的温度范围是 D
A.0~10℃ B.10~20℃ C.20~30℃ D.30~40℃
3.(94全国,25)100毫升0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度为 C
A.0.20 mol·L-1 B.0.25 mol·L-1 C.0.40 mol·L-1 D.0.50 mol·L-1
4.(95全国,9)下列说法正确的是(NA表示阿佛伽德罗常数的值) BC
A.在常温常压下,11.2升氯气含有的分子数为0.5NA
B.在常温常压下,1摩氦气含有的原子数为NA
C.32克氧气所含原子数目为2NA
D.在同温同压时,相同体积的任何气体单质所含的原子数目相同
5.(97全国,15)下列说法正确的是(NA表示阿伏加德罗常数的值) BC
A.在常温常压下,11.2 L N2含有的分子数为0.5NA
B.在常温常压下,1 mol Ne含有的原子数为NA
C.71 g Cl2所含原子数为2NA
D.在同温同压时,相同体积的任何气体单质所含的原子数相同
6.(97上海)设阿佛加德罗常数的符号为NA,下列叙述正确的是 C
A.1摩尔D2O所含质子数为12 NA
B.10克氖气所含原子数为NA
C.0.5 摩尔单质铝与足量盐酸反应转移电子数为1.5NA
D.标准状况下,升水所含分子数为1/22.4 NA
7.(01上海,16)设NA为阿佛加德罗常数,下列说法不正确的是 A
A.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
B.18g水中含有的电子数为10NA
C.46g 二氧化氮和46g四氧化二氮含有的原子数均为3NA
D.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
8.(02上海,8)NA为阿佛加德罗常数,下述正确的是 A
A.80g硝酸铵含有氮原子数为2NA
B.1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
C.标准状况下,11.2L四氯化碳所含分子数为0.5 NA
D.在铜与硫的反应中,1mol铜失去的电子数为2 NA
9.(03广东,14)设NA表示阿伏加德罗常数,下列叙述中正确的是 BC
A.常温常压下,11.2L氧气所含的原子数为NA
B.1.8g的NH4+离子中含有的电子数为NA
C.常温常压下,48gO3含有的氧原子数为3NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1NA
10.(03上海,3)以NA表示阿佛加德罗常数,下列说法中正确的是 B
A.53g碳酸钠中含NA个CO32-
B.0.1molOH-含NA个电子
C.1.8g重水(D2O)中含NA个中子
D.标准状况下11.2L臭氧中含NA个氧原子
11.(04江苏,11)阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是 BD
A.标准状况下,2.24L苯中约含有3.612x10z:个碳原子
B.常温常压下,氧气和臭氧的混合物16s中约含有6.0Q×1O23个氧原子
C.25℃时,1 L pH=13的氢氧化钠溶液中约含有6.02×l023个氢氧根离子
D.0.5mol CH4中约含有3.01×1024个电子
12.(04上海,19)设NA为阿佛加德罗常数,下列叙述中正确的是 AD
A. 46 g NO2 和 N2O4混合气体中含有原子数为3NA
B. 标准状况下22.4 L H2中含中子数为2NA
C. 1 L 1 mol/L醋酸溶液中离子总数为2NA
D. 1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
13.(04北京,9)用NA表示阿伏加德罗常数,下列叙述中正确的是 D
A.0.1 mol·L-1稀硫酸100 mL中含有硫酸根个数为0.1. NA
B.1 mol CH3+(碳正离子)中含有电子数为10 NA
C.2.4 g金属镁与足量的盐酸反应,转移电子数为 2 NA
D.12.4 g白磷中含有磷原子数为0.4 NA
14.(04天津,7)NA代表阿伏加德罗常数值,下列说法正确的是 D
A.9 g重水所含有的电子数为5 NA
B.1 mol MgCl2中含有离子数为NA
C.7.1 g氯气与足量NaOH溶液反应转移的电子数为0.2 NA
D.1 mol C10H20分子中共价键总数为13 NA
15.(00全国,21)硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100 mol·L-1 Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成 D
A.S2- B.S C.SO32- D.SO42-
16.(95全国,23)24mL 浓度为0.05 mol·L-1 的Na2SO3溶液,恰好与20mL 浓度为0.02 mol·L-1 的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是 B
A.+6 B.+3 C.+2 D.0
17.(95全国,24)在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当1.6克X与Y完全反应后,生成4.4克R,则在此反应中Y和M的质量之比为 A
A.16:9 B.23:9 C.32:9 D.46:9
18.(95全国,26)某温度下,在100克水中加入m克CuSO4或加入n克CuSO4·5H2O,均可使溶液恰好达到饱和,则m与n的关系符合 B
![]()
19.(96全国,17)用10mL 的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是 C
A.3:2:2 B.1:2:3 C.1:3:3 D.3:1:1
20.(96全国,19)在同温同压下,下列各组热化学方程式中,Q2>Q1的是 AC
A. 2H2(g)+O2(g)=2H2O(g) ;DH=- ![]() 2H2(g)+O2(g)=2H2O(l);DH=-
2H2(g)+O2(g)=2H2O(l);DH=- ![]()
B. S(g)+O2(g)=SO2(g) ;DH=- ![]() S(s)+O2(g)=SO2(g) ;DH=-
S(s)+O2(g)=SO2(g) ;DH=- ![]()
C. C(s)+![]() O2(g)=CO(g)
;DH=-
O2(g)=CO(g)
;DH=- ![]() C(s)+O2(g)=CO2(g) ;DH=-
C(s)+O2(g)=CO2(g) ;DH=- ![]()
D. H2(g)+Cl2(g)=2HCl(g) ;DH=- ![]()
![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g)
;DH=-
Cl2(g)=HCl(g)
;DH=- ![]()
21.(96全国,22)已知t℃时,某物质的不饱和溶液a克中含溶质m克,若该溶液蒸发b g水并恢复到t℃时,析出溶质m1克.若原溶液蒸发c g 水并恢复到t℃时,则析出溶质m2克.用S表示该物质在t℃时的溶解度,下式中正确的是 C
A.S=![]() B.S=
B.S= ![]() C. S=
C. S= ![]() D. S=
D. S= ![]()
22.(96全国,24)在化合物X2Y和YZ2中,Y的质量百分比分别约为40%和50%,则在化合物X2YZ3中Y的质量百分比约为 B
A.20% B.25% C.30% D.35%
23.(96全国,27)下列有关使用托盘天平的叙述,不正确的是 CD
A.称量前先调节托盘天平的零点
B.称量时左盘放被称量物,右盘放砝码
C.潮湿的或有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
D.用托盘天平可以准确称量至0.01g
24.(96上海,15)将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 A
A.3mol·L-1 HCl B.4mol·L-1 HNO3
C.8mol·L-1 NaOH D.18mol·L-1 H2SO4
25.(96上海,18)将60℃的硫酸铜饱和溶液100g ,冷却到20℃,下列说法正确的是 B
A.溶液质量不变 B.溶剂质量发生变化
C.溶液为饱和溶液,浓度不变 D.有晶体析出,溶剂质量不变
26.(97全国,22)密度为0.91 g/mL 的氨水,质量百分比浓度为25%(即质量分数为0.25),该氨水用等体积的水稀释后,所得溶液的质量百分比浓度 C
A.等于12.5% B.大于12.5% C.小于12.5% D.无法确定
27.(97上海,9)实验室需用480mL 0.1mol·L-1 的硫酸铜溶液,现选取500mL 容量瓶进行配制,以下操作正确的是 D
A.称取7.68克硫酸铜,加入500mL 水
B.称取12.0克胆矾配成500mL 溶液
C.称取8.0克硫酸铜,加入500mL 水
D.称取12.5克胆矾配成500mL 溶液
28.(97上海,26)在由Fe、FeO和Fe2O3组成的混合物中加入100毫升2mol·L-1 的盐酸,恰好使混合物完全溶解,并放出448mL 气体(标准状况),此时溶液中无Fe3+离子。则下列判断正确的是 BC
A.混合物里三种物质反应时消耗盐酸的物质的量之比为1:1:3
B.反应后所得溶液中的Fe2+离子与Cl- 离子的物质的量之比为1:2
C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
29.(98全国,5) 300 mL某浓度的NaOH溶液中含有60 g 溶质。现欲配制1mol·L-1 NaOH溶液,应取原溶液与蒸馏水的体积比约为 A
A.1:4 B.1:5 C.2:1 D.2:3
30.(98全国,16)依照阿佛加德罗定律,下列叙述正确的是 CD
A.同温同压下两种气体的体积之比等于摩尔质量之比
B.同温同压下两种气体的物质的量之比等于密度之比
C.同温同压下两种气体的摩尔质量之比等于密度之比
D.同温同体积下两种气体的物质的量之比等于压强之比
31.(98全国,20)由锌、铁、铝、镁四种金属中的两种组成的混和物10 g,与足量的盐酸反应产生的氢气在标准状况下为11.2 L ,则混和物中一定含有的金属是 C
A.锌 B.铁 C.铝 D.镁
32.(98全国,21)将标准状况下的a L 氯化氢气体溶于100 g 水中,得到的盐酸的密度为b g/mL,则该盐酸的物质的量的浓度是 D
A.![]() B.
B.![]()
C.![]() D.
D.![]()
33.在100g浓度为18mol/L、密度为ρ(g/cm3)的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入的水的体积为 A
A.小于100mL B.等于100mL C.大于100mL D.等于100/ρmL
34.甲、乙两烧杯中各成盛有100mL 3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为 A
A.5.4g B.3.6g C.2.7g D.1.6g
35.(99上海,12)已知某盐在不同温度下的溶解度(见下表), 若把质量分数为22%的该盐溶液由60℃逐渐冷却,则开始析出晶体的温度应在 D
A.0℃~10℃ B.10℃~20℃ C.20℃~30℃ D.30℃~40℃
36.(99上海,23)由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同。 则该混合气体中CO2H和CO的体积比为 CD
A.29:8:13 B.22:1:14 C.13:8:29 D.26:16:57
37.下列说法正确的是(NA表示阿伏加德罗常数的值) CD
A.28g氮气所含有的原子数目为NA
B.4g金属钙变成钙离子时失去的电子数目为0.1NA
C.lmol甲烷的质量与NA个甲烷分子的质量之和相等
D.标准状况下,22.4L甲烷和乙炔混合物所含的分子数为NA
38.(99全国)20.已知25%氨水的密度为0.91g.cm-3,5%氨水的密度为0.98g.cm-3,若将上述两溶液等体积混合,所得氨水溶液的质量分数是 B
 A. 等于15% B.大于15% C.小于15% D.无法估算
A. 等于15% B.大于15% C.小于15% D.无法估算
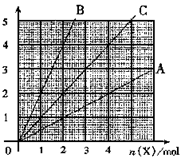
39.(99全国)21. 右图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量n(X).纵坐标表示消耗O2的物质的量n(O2),A、B是两种可燃气体,C是A和B的混合气化则C中n(A):n(B)为 A
A.2:1 B.1:2
C.1:1 D.任意比
40.(00广东,19)同温同压下两个容积相等的贮气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶内的气体时一定具有相同的 C
A.质量 B.原子总数 C.碳原子数 D.密度
41.(01广东)5.将Cu片放入0.1mol·L-1 FeCl3溶液中,反应一定时间后取出Cu片,溶液中[Fe3+]:[Fe2+]=2:3,则Cu2+与Fe3+的物质的量之比为 D
A.3:2 B.3:5 C.4:3 D.3:4
42.(01广东)12.将一定质量的Mg,Zn,Al混合物与足量稀H2SO4反应,生成H2 2.8L(标准状况),原混合物的质量可能是 BC
A.2g B.4g C.8g D.10g
43.(01全国,16)在无土栽培中,需配制一定量含50 mol NH4Cl、16 mol KCl和24 mol K2SO4的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是 B
A.2、64、24 B.64、2、24 C.32、50、12 D.16、50、24
44.(01全国)17.在100 mL 0.10 mol/L的 AgNO3溶液中加入100 mL溶有2.08 g BaCl2的溶液,再加入100 mL溶有0.010 mol CuSO4 · 5H2O的溶液,充分反应。下列说法中正确的是 B
A.最终得到白色沉淀和无色溶液
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.在最终得到的溶液中,Cl-的物质的量为0.02 mol
D.在最终得到的溶液中,Cu2+的物质的量浓度为0.10 mol·L-1
45.(02广东,8)将40mL 1.5m01.L-1 的CuS04 溶液与30mL 3 mo1.L-1 的NaOH溶液混合,生成浅蓝色沉淀,假如溶液中[Cu2+]或[OH—]都已变得很小,可忽略,则生成沉淀的组成可表示为 D
A.Cu(OH)2 B.CuS04·Cu(OH)2 C.CuS04·2Cu(OH)2 D.CuS04·3Cu(OH)2
46.(02全国,8)某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g。若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的溶质质量分数是 C
A.30% B.![]() ×100% C.26.5% D.
×100% C.26.5% D.![]() ×100%
×100%
47.(03广东,4)浓度为0.50mol·L-1的某金属阳离子Mn+的溶液10.00mL,与0.40mol·L-1的NaOH溶液12.50mL完全反应,生成沉淀,则n等于 A
A.1 B.2 C.3 D.4
48.(03广东,6)质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水,得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的分子量(相对分子质量)为 C
A.![]() B.
B.![]()
C.![]() D.
D.![]()
49.(03广东,8)等体积硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应。若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为 B
A.1:2:3 B.1:6:9 C.1:3:3 D.1:3:6
50.(03上海,17)某温度下,甲、乙两个烧杯中各盛有100 g相同浓度的KCl溶液,现将甲烧杯中的溶液蒸发掉35gH2O,析出晶体5g;乙烧杯中的溶液蒸发掉45gH2O,析出晶体10g。则原溶液的质量分数为 D
A.10% B.15% C.20% D.25%
51.(03全国,7)在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体。在同温同压下,两容器内的气体一定具有相同的 A
A.原子数 B.密度 C.质量 D.质子数
52.(03全国,12)某温度下向100g澄清的饱和石灰水中加入5.6g生石灰,充分反应后恢复到原来的温度,下列叙述正确的是 D
A.沉淀物的质量为5.6g B.沉淀物的质量为7.4g
C.饱和石灰水的质量大于98.2g D.饱和石灰水的质量小于98.2g
53.(04广东,6)下列有关溶液性质的叙述,正确的是 D
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体
B.20℃,100g水可溶解34.2g KCl,此时KCl饱和溶液的质量分数为34.2%
C.强电解质在水中溶解度一定大于弱电解质
D.相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧气的质量增加
54.(04全国,9)下列说法中不正确的是 D
A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14∶1
C.32g氧气所含的原子数目为2×6.02×1023
D.常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2L
55.(04全国,10)下列叙述正确的是 B
A.同温同压下,相同体积的物质,它们的物质的量必相等
B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.等体积、等物质的量浓度的强酸中所含的H+数一定相等
56.(04上海,20)下列两种气体的分子数一定相等的是 AB
A.质量相等、密度不等的N2和C2H4 B.等体积等密度的CO和C2H4
C.等温等体积的O2和N2 D.等压等体积的N2和CO2
57.(04北京,13)20℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0 mol·L-1,则下列说法中不正确的是 D
A.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1
B.此溶液中KCl的质量分数为![]()
C.20℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174g·cm-3
58.(04天津,11)在一定温度下,某无水盐R在水中溶解度为23 g,向R的饱和溶液中加入B g该无水盐,保持温度不变,析出R的结晶水合物W g,从原饱和溶液中析出溶质R的质量为 A
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
59.(05广东,3)NA为阿伏加德罗常数,下列说法正确的是 D
A.10g甲烷所含有的电子数目为10NA
B.常温常压下,4g氦气所含有的中子数目为4NA
C.标准状况下,22.4L单质溴所含有的原子数目为2NA
D.电解食盐水若产生2g氢气,则转移的电子数目为2NA
60.(05全国卷Ⅱ,9)NA代表阿伏加德常数,下列说法正确的是 D
A.在同温同压时,相同体积的任何气体单质所含的原子数目相同
B.2g氢气所含原子数目为NA
C.在常温常压下,11.2L氮气所含的原子数目为NA
D.17g氨气所含电子数目为10NA
61.(05江苏,10)阿伏加德罗常数约为6.02×1023 mol—1,下列叙述中正确的是 BD
A.常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023
B.室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023
C.标准状况下,22.4 L甲苯所含的分子数约为6.02×1023
D.标准状况下,a L甲烷和乙烷混合气体中的分子数约为![]() ×6.02×1023
×6.02×1023
62.(05上海,6)设阿伏加德常数为NA。则下列说法正确的是 C
A.常温常压下,11.2L甲烷中含有的氢原子数为2NA
B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.常温睛,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA
63.(05全国卷Ⅲ,12)在273 K和101 kPa的条件下,将2.00 g氦气、1.40 g氮气和1.60 g氧气混合,该混合气体的体积是 D
A. 6.72 L B. 7.84 L C.10.08 L D.13.44 L
64.(05全国卷I,8)已知Q与R的摩尔质量之比为9:22。在反应X + 2Y = 2Q + R中,当1.6gX与Y完全反应后,生成4.4gB,则参与反应的Y和生成物Q的质量比为 D
A.46:9 B.32:9 C.23:9 D.16:9
65.(05江苏,16)在一定条件下,1体积气体A2和3体积气体B2完全反应生成了2体积气体X(体积在相同条件下测定),则X的化学式是 D
A.AB B.A2B3 C.AB2 D.AB2
66.(05上海,17)某500mL溶液中含0.1molFe2+、0.2molFe3+,加入0.2mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变) C
A.0.4mol/L B.0.6mol/L C.0.8mol/L D.1.0mol·L-1
67.(06上海,12)NA代表阿伏加德罗常数,下列说法正确的是 C
A.9gD2O中含有的电子数为5NA
B.1molMgCl2中含有的离子数为2NA
C.1molCH4分子中共价键总数为4NA
D.7.1g C12与足量NaOH溶液反应转移的电子数为0.2NA
68.(06全国理综I,8 )用NA代表阿伏加德罗常数,下列说法正确的是 C
A.0.5mol Al与足量盐酸反应转移电子数为1NA
B.标准状况下,11.2L SO3所含的分子数为0.5NA
C.0.1molCH4所含的电子数为1NA
D.46g NO2和N2O4的混合物所含的分子数为1NA
69.(06重庆理综,7)设NA代表阿伏加德罗常数,下列说法正确的是 D
A.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B.100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA
D.20 g重水(D2O)中含有的电子数为10NA
70.(06江苏,6)阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是 C
A.1.0L 1.0mol·L-1CH3COOH溶液中,CH3COOH分子数为6.02×1023
 B.Na2O2与H2O反应生成1.12L O2(标准状况),反应中转移的电子数为2×6.02×1023
B.Na2O2与H2O反应生成1.12L O2(标准状况),反应中转移的电子数为2×6.02×1023
C.32 g S8单质中含有的S—S键个数为6.02×1023
D.22.4 L N2中所含的分子数为6.02×1023
71.(06四川理综,8)在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是 D
A.两种气体的压强相等 B.O2比O3的质量小
C.两种气体的分子数目相等 D.两种气体的氧原子数目相等
72.(06广东,12 )下列条件下,两瓶气体所含原子数一定相等的是 AC
A.同质量、不同密度的N2和CO B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4和C3H6 D.同压强、同体积的N2O和CO2
73.(06全国理综Ⅱ,9)某氯化镁溶液的密度为1.18g•cm-1 ,其中镁离子的质量分数为5.1%。300mL该溶液中Cl-离子的物质的量约等于 D
A. 0.37mol B. 0.63mol C. 0.74mol D.1.5mol
74.(06上海,8)某非金属单质A和氧气发生化合反应生成B。B为气体,其体积是反应掉氧气体积的两倍(同温同压)。以下对B分子组成的推测一定正确的是
A.有1个氧原子 B.有2个氧原子
C.有1个A原子 D.有2个A原子
75.(06上海,15)在标准状况下,向100mL氢硫酸溶液中通人二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为 D
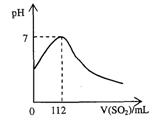
A.0.5mol/L B.0.05mol/L C.1mol/L D.0.1mol/L
76.(2007年高考上海化学卷,4)下列有关物理量相应的单位表达错误的是 C
A.摩尔质量g/mol B.气体摩尔体积L/mol
C.溶解度g/100g D.密度g/cm3
77.(2007年高考广东理基,22)已知阿伏加德罗常数为NA,下列说法正确的是 C
A.2 mol重水含有NA个D2O分子
B.1 g氢气含有NA个H2分子
C.2 mol钠与过量稀盐酸反应生成NA个H2分子
D.22.4 L水含有NA个H2O分子
78.(2007年高考广东化学卷,3)下列叙述正确的是 A
A.48 g O3气体含有6.02×1023个O3分子
B.常温常压下,4.6 g NO2气体含有1.81×1023个NO2分子
C.0.5 mol·L-1 CuCl2溶液中含有3.01×1023个Cu2+
D.标准状况下,33.6 L H2O含有9.03×1023个H2O分子
79.(2007年高考江苏卷,8)阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是 D
A.2.24 L CO2中含有的原子数为0.3×6.02×1023
B.0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023
C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023
D.4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023
80.(2007年高考上海化学卷,20)设NA为阿伏加德罗常数,下列叙述中正确的是 B
A.常温下11.2 L的甲烷气体含有甲烷分子数为0.5NA个
B.14 g乙烯和丙烯的混合物中总原子数为3NA个
C.0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1NA个
D.5.6 g铁与足量的稀硫酸反应失去电子数为0.3NA个
81.(2007年高考理综宁夏卷,10)若NA表示阿佛加德罗常数,下列说法正确的是 C
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C.14 g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4
82.(2007年高考理综四川卷,7)用NA代表阿伏加德罗常数,下列说法正确的是 B
A.标准状况下,22.4 L CHCl3中含有的氯原子数目为3NA
B.7 g CnH2n中含有的氢原子数目为NA
C.18 g D2O中含有的质子数目为10NA
D.1 L 0.5 mol/L Na2CO3溶液中含有的CO32 -数目为0.5NA
83.(2007年高考理综重庆卷,7)下列叙述中正确的是 B
A.相同条件下,N2和O3混合气与等体积的N2所含原子数相等
B.等物质的量的甲基(—CH3)和羟基(—OH)所含电子数相等
C.常温常压下28 g CO与22.4 L O2所含分子数相等
D.16g CH4与18 g NH4+ 所含质子数相等
84.(2007年高考海南化学卷,4)下列叙述正确的是 B
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
85.(2007年高考全国理综卷I,9)在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是 D
A.p(Ne)>p(H2)>p(O2) B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne) D.p(H2)>p(Ne)>p(O2)
86.(2007年高考理综宁夏卷,12)a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为 B
A.1:7 B.7:1 C.7:8 D.8:7
87.(2007年高考海南化学卷,12)有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为 D
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
88.(2007年高考上海化学卷,12)往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量m(沉淀)与加入AgNO3溶液体积V(AgNO3)的关系如图所示。则原溶液中c(I-)/c(Cl-)的比值为 C
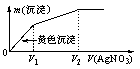
A.(V2-V1)/V1 B.V1/V2 C.V1/(V2-V1) D.V2/V1
89.(94全国,36)(7分)称取0.200克某赤铁矿样品,矿样溶解后,使其中的铁全部转化成Fe2+(所得溶液中不含其他还原性物质).另称7.90克硫酸铈.2(NH4)2SO4·Ce(SO4)2·2H2O (摩尔质量为632克/摩尔),溶解后稀释至250毫升.取该溶液30.0毫升恰好与上述Fe2+溶液完全反应.反应的离子方程式为:Ce4++Fe2+=Ce3++Fe3+.请计算该矿样中Fe2O3的质量百分含量)(Fe2O3摩尔质量为160克/摩尔).
答案:c(Ce4+)=0.0500 mol·L-1 ω(Fe2O3)=60%
90.(05广东,27)化合物KxFe(C2O4)y· zH2O是一种重要的光化学试剂,其中铁为+3价。分别称取该样品0.49lg两份,其中一份在110℃干燥脱水,至质量恒定为0.437g。另一份置于锥形瓶中,加入足量的3 mol·L-1 H2SO4和适量的蒸馏水,加热至75℃,趁热加入0.0500mol·L-1KMnO4溶液24.0mL,恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3-完全转化为Fe2+,该溶液中Fe2+刚好与4.0 mL0.0500mol·L-1KMnO4溶液完全反应。通过计算,分别求:
(1)0.49lg样品中结晶水的物质的量。
(2)化合物中草酸根的质量分数。
(3)化合物的化学式。
己知:2 KMnO4 + 5 H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2↑+ 8H2O
MnO4- +5Fe2++8H+=Mn2+ + 5Fe3+ + 4H2O
答案:(1) n(H2O) =0.00300 mol (2) ω(C2O42-) =53.8 %
(3)化合物的化学式为:K3Fe(C2O4)3·3H2O
91.(99全国)在热的稀硫酸溶液中溶解了11.4g FeSO4。当加入50mL 0.5mol/L KNO3溶液后,使其中Fe2+的全部转化成Fe3+,KNO3也反应完全,并有NXOY氮氧化物气体逸出。
FeSO4 + KNO3 + H2SO4 →K2SO4 +Fe2(SO4)3+ NXOY+H2O
(1)推算出X= Y=
(2)配平该化学方程式(系数填写在上式方框内)
 (3)反应中氧化剂为
(3)反应中氧化剂为
(4)用短线和箭头标出电子转移的方向和总数
答案:(1)1 1 (2)6 2 4-1 3 2 4 (3)KNO3 (4) FeSO4 KNO3
92.(95全国,35)(7分)取50.0mL Na2CO3和Na2SO4的混和溶液,加入过量BaCl2溶液后得到14.51克白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66克,并有气体放出.试计算:
(1)原混和溶液中Na2CO3和Na2SO4的物质的量浓度;
(2)产生的气体在标准状况下的体积。
答案:(1)c(Na2SO4)=0.4OML·L-1 c(NaCO3)=1.0mol·L-1 (2)V(CO2)=1.12L
93.(96全国,35)某化合物的化学式可表示为CO(NH3)xCly(x,y均为正整数)。为确定x和y的值,取两份质量均为0.2140g 的该化合物进行如下两个实验。将一份试样溶于水,在硝酸存在的条件下用AgNO3溶液滴定(生成AgCl沉淀),共消耗24.0mL 0.100mol·L-1 的AgNO3溶液。在另一份试样中加入过量NaOH溶液并加热,用足量盐酸吸收逸出的NH3,吸收NH3共消耗24.0mL 0.200mol·L-1 HCl溶液。试通过计算确定该化合物的化学式。(原子量:H—1.0 N—14.0 Cl—35.5 Co—58.9)
答案:该化合物的化学式为CO(NH3)6Cl3
94.(96上海,36)六价铬对人体有毒,含铬废水要经化学处理后才能排放,方法是用绿矾(FeSO4·7H2O)把废水中的六价铬还原为三价铬离子,再加入过量的石灰水,使铬离子转变为氢氧化铬Cr(OH)3沉淀.其主要反应的化学方程式如下:H2Cr2O7+6FeSO4+6H2SO4=3Fe2(SO4)3+Cr2(SO4)3+7H2O 现用上法处理1×104 L 含铬(+6价)78 mg·L-1 的废水(Cr相对原子质量52),试回答:
(1)处理后,沉淀物中除Cr(OH)3外,还有 、 (用化学式表示).
(2)需用绿矾多少千克?
答案:(1)Fe(OH)3 CaSO4 (2)m(FeSO4·7H2O)=12510(克)=12.51(千克)
95.(98全国,34)本题分子量用以下数据:H2O=18.0 CaO=56.0 CaO2=72.0
过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某过氧化物样品的组成,进行了如下实验。
①称取0.270克样品,灼热使之完全分解,生成CaO、O2和H2O,得到的O2在标准状况下的体积为33.6毫升。
②另取0.120克样品,溶于稀盐酸,加热煮沸使生成的H2O2完全分解。然后将溶液中的Ca2+完全转化成CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.0200摩/升KMnO4溶液滴定,共用去31.0毫升KMnO4溶液。化学方程式如下:
5CaC2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5CaSO4+10CO2+8H2O
(1)写出CaO2受热分解的化学方程式。
(2)计算样品中的CaO2的质量分数。
(3)计算样品中的CaO2·xH2O的x值。
答案:(1)2CaO2 = 2CaO+O2 (2)w(CaO2)=80% (3)x=0.5
96.(98全国,35)下面是四种盐在不同温度下的溶解度(克/100克水)
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
(计算时假定:①盐类共存时不影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计。)
(1)取23.4克NaCl和40.4克KNO3,加70.0克H2O,加热溶解。在100℃时蒸发掉50.0克H2O,维持该温度,过滤出晶体,计算所得晶体的质量(m高温)。将滤液冷却至10℃,待充分结晶后,过滤。计算所得晶体的质量(m低温)。
(2)另取34.0克NaNO3和29.8克KCl,同样进行如上实验。10℃时析出的晶体是 (写化学式)。100℃和10℃得到的晶体质量(m¢高温和m¢低温)分别是多少?
答案:(1)m(高温)=15.6g m(低温)=36.9g
(2)KNO3和NaCl (1分)
m¢(高温)=m(高温)=15.6g
m¢(低温)=m(低温)=36.9g
97.(99上海,33)自然界存在的碳酸盐类铜矿(如孔雀石、石青等)的化学组成为:aCuCO3·bCu(OH)2 (a,B为正整数,且a≤2b≤2为正整数,且(1)将孔雀石、石青矿样分别加盐酸至完全溶解,耗用HCl物质的量与产生CO2物质的量之比:孔雀石为4:1;石青为3:1。它们的化学组成为:孔雀石:石青:(2)今有一份碳酸盐类铜矿样品,将其等分为A、B两份。然后,加盐酸使A样品完全溶解,产生CO233.6L(标准状况);加热B样品使其完全分解,得到20gCuO。试计算并确定该矿石的化学组成。(3)某碳酸盐类铜矿样加酸完全溶解后,产生CO26.72L(标准状况),这份矿样中CuO含量不低于 克(4)设某碳酸盐类铜矿样的质量为A克,所含CuO质量为G克。加酸完全溶解后,产生的CO2体积(标准状况)为V升,则含铜矿样的A、V、G之间的关系式为:A=
答案:(1)孔雀石 CuCO3·Cu(OH)2 石青 2 CuCO3·Cu(OH)2 (2)组成为: CuCO3·Cu(OH)2与2 CuCO3·Cu(OH)2混合物 (3)36克 (4)A=124![]()
98.(00全国,29)将某温度下的KNO3溶液200g蒸发掉10g水,恢复到原温度,或向其中加入10gKNO3固体,均可使溶液达到饱和。试计算:
(1)该温度下KNO3的溶解度。
(2)原未饱和溶液中溶质的质量分数。
答案:(1)该温度下KNO3的溶解度为100g (3分)
(2)原来饱和溶液中溶质的质量分数为47.5%
蒸发掉10gH2O得到190g饱和溶液,根据溶解度其溶质为95g。故原来饱和溶液中溶质的质量分数为![]()
(或加10gKNO3得到210g饱和溶液,其溶质为105g。故原来饱和溶液中溶质为95g,质量分数为![]() )
)
99.(01广东,23)已知脊椎动物的骨骼中含有磷。以下是测定动物骨灰中磷元素含量的实验方法。称取某动物骨灰样品0.103 g,用硝酸处理,使磷转化成磷酸根。再加入某试剂,使磷酸根又转化成沉淀。沉淀经灼烧后得到组成为P2Mo24O77的固体(其式量以3.60×103计)0.504 g。
试由上述数据计算该骨灰样品中磷的质量分数。(磷的相对原子质量以31.0 计。)
答案:n(P2Mo24O77)=(0.504 g / 3.60×10.3 g·mol-1)
其中P的质量为:(0.504 g × 2 × 31.0 g·mol-1)/(3.60×10.3 g·mol-1)
P的质量分数:(0.504 g × 2 × 31.0 g·mol-1)/(3.60×103 g·mol-1 × 0.103 g)=0.0843 (或8.43%)
100.(01全国,20)某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图,导管出口高于液面)。
⑥测量收集到气体的体积。
⑦准确称量试管和残留物的质量为b g。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
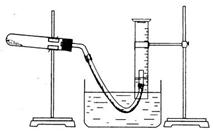
回答下列问题:
(1)如何检查装置的气密性?____________________________________________。
(2)以下是测量收集到气体体积必须包括的几个步骤;①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是:__________________________________(请填写步骤代号)
(3)测量收集到气体体积时,如何使量筒内外液面的高度相同?
____________________________________________________________。
(4)如果实验中得到的氧气体积是c L(25 ℃、1.01×l05 Pa),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):
M(O2)= __________________________________________。
答案:(1)将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。
(2)②①③
(3)慢慢将量筒下移 (4)![]()
101.(01全国,21)在120 ℃时分别进行如下四个反应:
A.2H2S+O2 ==2H2O+2S B.2H2S+3O2 ==2H2O+2SO2
C.C2H4+3O2==2H2O+2CO2 D.C4H8+6O2==4H2O+4CO2
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前=d后和 p前> p后的是____________;符合关系式d前=d后和 p前= p后的是__________________(请填写反应的代号)。
(2)若反应在压强恒定容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和 V前<V后的是____________;符合d前>d后和 V前>V后的是_________________(请填写反应的代号)。
答案:(1)B;C (2)D;A
102.(01全国,25)标准状况下,用一定量的水吸收氨气后制得浓度为12.0 mol/L、密度为
0.915 g/cm3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。
(本题中氨的式量以 17.0计,水的密度以1.00 g/cm3计)
答案:1体积水吸收378体积NH3气(标准状况)
103.(03广东,25)取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1.00mol·L-1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100mol·L-1Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00ml·L-1盐酸恰好完全中和。计算混合物中各物质的质量。
答案:m(Na2CO3)=7.42g m(NaHCO3)=1.68g
104.(03上海,33)黄铜矿(主要成分CuFeS2)是提取铜的主要原料
(1)取12.5 g黄铜矿样品,经测定含3.60 g硫(杂质不含硫),矿样中CuFeS2含量为
(2)已知:2CuFeS2+4O2 ![]() Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
产物Cu2S在1200℃高温下继续反应:
2Cu2S + 3 O2 → 2Cu2O + 2 SO2
2 Cu2O + Cu2S → 6Cu + SO2
假定各步反应都完全,完成下列计算:
① 由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量
② 6 mol CuFeS2和14.25 mol O2反应,理论上可得到多少摩尔铜?
③ 6 mol CuFeS2和15.75 mol O2反应,理论上可得到多少摩尔铜?
答案:(1)82.8% (2)① CuFeS2 ![]() Cu+FeO+2SO2
Cu+FeO+2SO2
n(O2)=(![]() +2)×6 mol=15 mol
+2)×6 mol=15 mol
② O2不足量 2CuFeS2+4O2 ![]() Cu2S+3SO2+2FeO
Cu2S+3SO2+2FeO
6 mol 12 3
Cu2S + O2 ® 2Cu+SO2
(14.25-12) x=4.5
③ O2过量 4Cu + O2 → 2Cu2O
(15.75-15) y=1.5 mol
n( Cu )=6-1.5 mol×2=3 mol
解析:从上述化学方程式可知,生成物为Cu、FeO、SO2。只须配平下面的化学方程式就能很好地解题。6CuFeS2+15O2=6Cu+6FeO+12SO2
105.(04广东,26)孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
xCuCO3•yCu(OH)2 (x、y为正整数且x≤2,y≤2)
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1。请推算它们的化学组成。孔雀石: 石青:
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36L(标准状况下);加热另一份样品使其完全分解,得到CuO 20g,试通过计算确定该混合物中孔雀石和石青的物质的量之比。
答案:(1)孔雀石的化学式为 CuCO3•Cu(OH)2 石青的化学式为 2CuCO3•Cu(OH)2
(2)孔雀石与石青物质的量之比为1:1
|
106.(04全国,29)抗击“非典”期间,过氧乙酸( )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
① □MnO4+□H2O2+□H+===□Mn2++□O2十□H2O
② H2O2+2![]() +2H===I2+2H2O
+2H===I2+2H2O
|
③
+2![]() +2H+===CH3COOH+I2+H2O
+2H+===CH3COOH+I2+H2O
④ I2 + S2O32- =2I- + S4O62-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
□MnO4+□H2O2+□H+===□Mn2++□O2十□H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是___________________________。
(3)取b0
mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·![]() 的KmnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
的KmnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
另取b0
mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成
I2(反应②和③)。再用浓度为a2 mol·![]() 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。c0= ___________。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 _______________(填是或否)
答案:(1) 2 5 6
2 5 8 (2)淀粉溶液 (3)![]() (4)否
(4)否
107.(04上海,30)氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50 g试样溶于蒸馏水配成100 mL溶液,从中取出10.0 mL溶液于锥形瓶中,加2滴指示剂,用0.100 mol / L HCl标准溶液滴定至终点,共消耗标准液20.0 mL(杂质不与酸反应),求试样中氢氧化钡的物质的量。
(2)另取5.25 g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09 g,求Ba(OH)2·nH2O中的n值。
(3)试样中Ba(OH)2·nH2O的质量分数为 。
答案:(1)0.01 mol (2)n=8 (3)ω[Ba(OH)2·nH2O]=0.90
108.(05上海,30)过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO。
(1)称取0.542g过氧化钙样品,灼热时发生如下反应:2CaO2·XH2O ![]() 2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 。
2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 。
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g。
① 试计算样品中CaO的质量。
② 试计算样品中CaO2·XH2O的X值。
答案:(1)0.006mol (2)① m(CaO) = 0.056g ② X = 1/2
109.(05广东,26)某研究性学习小组欲用化学方法测量一个不规则容器的体积。把35.1g NaCl放入500 mL烧杯中,加入150 mL蒸馏水。待NaCl完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释至完全充满容器。从中取出溶液100mL,该溶液恰好与20 mL 0.100 mol·L-1AgNO3溶液完全反应。试计算该容器的体积。
答案:V容器 =30L