高三化学第一次考试
化 学 试 题
第I卷(选择题 共70分)
可能用到的原子量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Na-23 K-39
Si-28
一.选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1、有一胶体,其胶粒带正电,对这种胶体溶液进行下列处理,不发生聚沉的是
A.加硫酸钠溶液 B.加热 C.加硅酸胶体 D.加氢氧化铁胶体
2. 已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+;MnO4-→Mn2+;Cl2→Cl-;HNO2→NO。
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A.Fe3+ B.MnO4- C.Cl2 D.HNO2
3.下列叙述中,不正确的是
①原子晶体中只含有极性键 ②金属在常温时都以晶体形式存在
③离子晶体一定含离子键,也可能有共价键 ④分子晶体中一定有分子间作用力,有的还可能有氢键
A.①④ B.②③ C.①② D.①③
4.下列说法中正确的是( )
A.冰、水和水蒸气中都存在氢键
B.除稀有气体外的非金属元素都能生成不同价态的含氧酸
C. 金属离子和自由电子间通过金属键形成的晶体是金属晶体
D.CO2与SiO2都是分子晶体,所以它们有接近的熔、沸点
5.氯化铁溶液与氢氧化铁胶体具有的共同性质是
A. 分散质颗粒直径都在l~100nm之间 B. 能透过半透膜
C. 加热蒸干、灼烧后都有氧化铁生成 D. 呈红褐色
6.已知25℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)===CO2(g); △H=-393.51 kJ·mol-1
C(金刚石)+O2(g)===CO2(g); △H=-395.41 kJ·mol-1
据此判断,下列说法正确的是
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
7.美国(科学)杂志报道,在40GPa高压下,用激光加热到1800K,人们成功制得了原子晶体干冰,下列推断正确的是:
A、原子晶体干冰有很高的熔、沸点,有很大的硬度;
B、原子晶体干冰易气化,可用作制冷材料;
C、原子晶体干冰硬度小,可用作润滑材料;
D、每摩尔原子晶体干冰中含2 mol C—O键;
8.下列物质性质的变化规律与分子间作用力有关的是
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
9.希尔实验是将分离出的叶绿素加到草酸铁溶液中,经光照后发生反应:4Fe3++2H2O光照叶绿体4Fe2++4H++O2↑,下列有关该实验的说法错误的是
A.反应后溶液的pH降低 B.每生成1 mol O2转移4 mol电子
C.叶绿体被氧化 D.该实验可说明光合作用产生的氧气来源于水
10.下列物质中,可溶于水的是
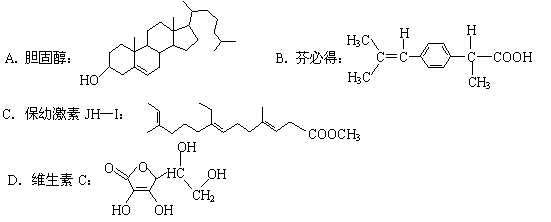 |
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
11.设NA为阿伏加德罗常数,下列说法中正确的是
A.标准状况下,11.2L的氮气和氨气的混合气体的原子总数为3NA
B.标准状况下,1mol石英晶体中所含硅氧(Si-O)键的数日为4NA
C.标况下气体摩尔体积约22.4L/mol,非标准状况下气体摩尔体积不可能是22.4L/mol
D.常温常压下,16g甲烷与氯气发生取代反应最多需要氯气的分子数为4NA
12.在含有S2—离子,且滴加酚酞显红色的溶液中,能大量共存的离子组是
A.NH4+、Ba2+、C1—、AlO2— B. SO42—、NO3—、Fe2+、A13+
C.C1—、SO32—、Na+、K+ D.Na+、K+、C1O—、Cl—
13.能正确表示下列化学反应的离子方程式是
A.Fe(OH)3溶于HI溶液中:Fe(OH)3十3H+== Fe3+十3H2O
B.除去了表面氧化膜的铝片插入氯化铜溶液中:Al十Cu2+== A13+十Cu
C.碳酸钙溶于盐酸中:CaCO3十2H+==Ca2+十CO2↑十H2O
D.碳酸钠溶液呈碱性:CO32—十H2O== HCO3—十OH—
14.已知C3N4晶体很可能具有比金刚石还大的硬度,且每个原子最外层均满足8e
稳定结构。下列关于C3N4晶体的说法正确的是
A.C3N4晶体可能是分子晶体,晶体中微粒间通过共价键相结合
B.C3N4晶体中,C—N键的键长比金刚石中的C—C键的键长要长
C.C3N4晶体中每个C原于连接4个N原于,每个N原于连接3个C原于
D.C3N4晶体中每个N原于上还有2个未共用的电子
15.Na3N是离子化合物,它能与水反应生成氨气。以下关于Na3N的说法中正确的是:
A.Na3N与盐酸反应时生成两种盐
B.在Na3N与水反应中Na3N是还原剂
C. Na3N分子中Na+的半径比N3-的半径小
D.Na+ 与 N3-的电子层都与氩原子的结构相同
16.氯化碘(ICl)的性质类似卤素,有很强的化学活动性。ICl跟Zn、H2O的
反应如下:①2ICl+2Zn=ZnCl2+ZnI2 ②ICl+H2O=HCl+HIO
下列叙述中正确的是 :
A. 在反应①中,ZnI2既是氧化产物又是还原产物
B.在反应①中,ZnCl2既是氧化产物又是还原产物
C.在反应②中,ICl既是氧化剂又是还原剂
D. 在反应②中,ICl既不是氧化剂,又不是还原剂
17.目前科学界拟合成一种“双重结构”的球形分子,即把足球烯C60的分子容纳在Si60分子中,外面的硅原子与里面的碳原子以共价键结合,下列叙述不正确的是
A、该反应为置换反应 B、该晶体为分子晶体
C、该物质是一种新化合物 D、该物质的相对分子质量为2400
18.有下列离子晶体空间结构示意图:●为阳离子,○为阴离子。以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为
A 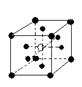 B
B 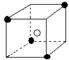 C
C 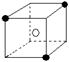 D
D 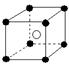
19、化合物Fe0.95O具有NaCl型结构。由于n(Fe):n(O)<1,所以晶体存在缺陷,Fe0.95O可表示为
A、Fe0.452+Fe0.53+O B、Fe0.852+Fe 0.103+O C、Fe0.152+Fe0.803+O D、Fe0.22+Fe 0.753+O
20.在一密闭容器中。反应mA(g)+nB(g)![]() pC(g)达平衡时,测得c(A)为0.5
mol•L—1 ;在温度不变情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.3 mol•L—1,则下列判断正确的是
pC(g)达平衡时,测得c(A)为0.5
mol•L—1 ;在温度不变情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.3 mol•L—1,则下列判断正确的是
A.化学计量数:m+n>p B.平衡向正反应方向移动了
C.物质B的转化率减小了 D.物质C的质量分数增加了
第II卷(非选择题 共80分)
三.(本题包括2小题,共21分)
21、(13分)利用下列装置进行实验,可证明碳和浓硫酸反应放出的气体。已知下图中4个洗气瓶均装有检测液,现给出4种溶液:①酸性高锰酸钾溶液;②品红溶液;③澄清石灰水;④浓硫酸。
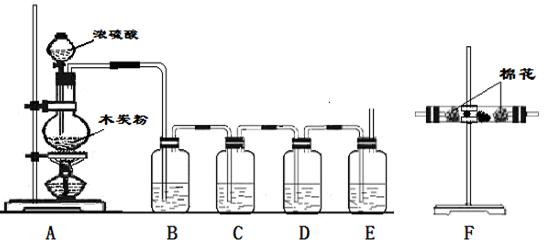
(1)写出木炭粉和浓硫酸反应的化学方程式:___________________。
(2)试指出B、C、D、E各洗气瓶所盛液体的名称和作用。
B.__________________,______________________________________
C.__________________,_____________________________________
D.__________________,_____________________________________
E.__________________,______________________________________。
(3)上述装置只能证明木炭粉和浓硫酸反应生成的部分气体,为了验证生成的另一种物质可在_____________装置之间连接F装置,F装置所盛有的试剂是____________,其现象是________________________。
22.(8分)某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。
②装好实验装置。
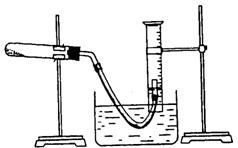 ③检查装置气密性。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图,导管出口高于液面)。
⑥测量收集到气体的体积。
⑦准确称量试管和残留物的质量为bg。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
回答下列问题:
⑴如何检查装置的气密性?
(2)以下是测量收集到气体体积必须包括的几个步骤;①调整量简内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量简内气体的体积。这三步操作的正确顺序是: (请填写步骤代号)。
(3)测量收集到气体体积时,如何使量简内外液面的高度相同?
(4)如果实验中得到的氧气体积是c L(0℃、1.0×105Pa),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):
M(O2)=
四、(本题共3小题,23分)
23.(7分)PbO2是很强的氧化剂,在酸性溶液中它可将Mn2+氧化成MnO4-。取一支试管,加少量PbO2固体和2 mL的6mol·L-1H2SO4,然后再加2 mL的1mol·L-1MnSO4溶液,试回答:
⑴搅拌后,溶液的颜色变化是 。
⑵反应的离子方程式是 。(PbSO4是难溶物)
⑶能否用盐酸来代替硫酸 (填“能”或“不能” ),用离子方程式解释: 。
 24.(8分)从NaCl晶体中可以抽取出不同形状的晶体小碎片,这些晶体小碎片可以称为NaCl离子团簇。离子晶体或离子团簇表面存在悬挂键(即表面的离子有一种没有抓住相邻原子的化学键)。右图是立方体形状的NaCl离子团簇,其中大球代表Cl—,小球表代Na+。请回答下列问题:
24.(8分)从NaCl晶体中可以抽取出不同形状的晶体小碎片,这些晶体小碎片可以称为NaCl离子团簇。离子晶体或离子团簇表面存在悬挂键(即表面的离子有一种没有抓住相邻原子的化学键)。右图是立方体形状的NaCl离子团簇,其中大球代表Cl—,小球表代Na+。请回答下列问题:
① 与等质量的NaCl离子晶体相比,NaCl离子团簇具有 (填“较多”或“较少”)的悬挂键:
② NaCl离子团簇的熔点比NaCl大块晶体的熔点要 (填“高”、“低”或“—样”);
③ 如果团簇中离子对数相同,则团簇的总能量与团簇的外形是否有关 。
④ 食盐晶体由钠离子和氯离子组成,这两种离子在空间的三个垂直方向都是等距离地交错排列。已知食盐的密度是2.2g/cm3,则食盐中相邻的钠离子核间的数值最接近于( )
A.3.0×10-8cm B.3.5×10-8cm C.4.0×10-8cm D.5.0×10-8cm
25.(8分)下图每一方框中的字母代表一种反应物或生成物:
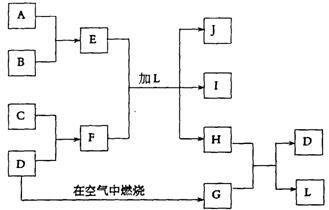
产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(l)L的化学式为: 。
(2)F的化学式为: 。
(3)写出J受热分解反应的化学方程式: 。
(4)H和G之间反应的化学方程式为: 。
五、(本题包括2小题,共20分)
26.(8分)2,5—联苯二甲酸(PTA)是一个重要的高分子合成单体。PTA的合成对于高强度、高模量纤维的制备及高分子液晶的理论研究具有十分重要的意义。下面是PTA的主要合成路线。
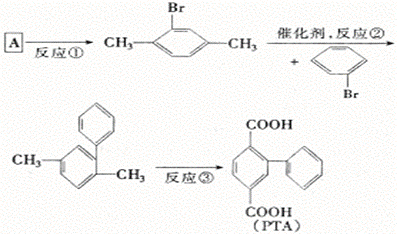
(1)上述反应中属于取代反应的是 。
(2)反应③所加试剂为 ,反应类型为 。
(3)A的结构简式为 ,名称 。
(4)A的同分异构体有 种.
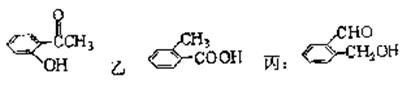
27.(12分)有化合物 甲:
(1)请写出丙中含氧官能团的名称:_______________________________________。
(2)请判别上述哪些化合物互为同分异构体:_______________________________________。
(3)请分别写出鉴别甲、乙、丙化合物的方法(指明所选试剂及主要现象即可)。
鉴别甲的方法:____________________________________________________________-。
鉴别乙的方法:___________________________________________________________。
鉴别丙的方法:___________________________________________________________。
(4)请按酸性由强至弱排列甲、乙、丙的顺序:______________________________。
六、本题包括2小题,共16分
28.(6分)K2CO3、KHCO3混合粉末mg,加热到质量不再减少为止,剩余物质的质量为ng,则:
(1)混合物K2CO3的质量为 g。
(2)题干条件中n的数值应满足的范围是 。
(3)若将加热前的该混和粉末与足量盐酸反应,将所得溶液蒸干,可得KCl固体的质量为 g。
29.(本题10分)已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;
②Br2能将I-氧化为I2;
③KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2。
现向含有lmolKI的硫酸溶液中加入含a molKBrO3的溶液,a的取值不同,
所得产物也不同。
(1)试将讨论的结果填入表中:
| 编号 | a的取值范围 | 产物的化学式(或离子符号) |
| ① | I2 、、Br- | |
| ② | 1/6 < a < 1/5 | |
| ③ | I2、、IO3-、、Br2 | |
| ④ | a ≥ 6/5 |
(2)对表中③组:当n(I2) = n(IO3-)时,求a的值。
第二次考试参考答案及评分标准
选择题答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | B | C | C | C | A | A | D | C | D |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| BD | C | C | CD | AC | AD | A | B | B | AC |
第二卷答案
21、(1) C +2H2SO4(浓)=====CO2↑+2SO2↑+2H2O (2分)
(2) B:品红溶液,证明生成了SO2; (2分)
C: 酸性高锰酸钾,除去SO2; (2分)
D: 品红溶液,检验SO2是否除尽; (2分)
E: 澄清石灰水,证明CO2的存在。 (2分)
(3) AB;无水CuSO4;无水CuSO4变蓝。(3分)
22.(1)将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。(2分)
(2)②①③(2分)(3)慢慢将量筒下移(2分)
(4)![]() (2分)
(2分)
23.(7分)⑴无色变为紫红色。(2分)
⑵ 2Mn2++5 PbO2+5 SO42-+4H+=2MnO4-+5PbSO4↓+2 H2O (2分)
⑶不能 (1分) , PbO2+2 Cl-+4H+= Cl2↑+Pb2++2 H2O (2分)
24.①较多 ② 低 ③ 有关 ④ C (每空2分)
25.(1)H2O(2分)(2)Na2S(2分)
(3)2Al(OH)3![]() Al2O3+3H2O(2分)(4)2H2S+SO2=3S+2H2O(2分)
Al2O3+3H2O(2分)(4)2H2S+SO2=3S+2H2O(2分)
26、(1) ①② (2分)
(2) 酸性KMnO4或K2Cr2O7或强氧化剂 氧化反应 (2分)
(3) 对二甲苯(结构简式:略)(2分)
(4) 4 (2分)
27.(1)羟基 醛基(2分)
(2)甲、乙、丙均互为同分异构体。(2分)
(3)鉴别甲:与FeCl3溶液反应显紫色的是甲(2分)
鉴别乙:与Na2CO3溶液反应产生气泡的是乙(2分)
鉴别丙:与银氨溶液(水溶加热)产生银镜的是丙(2分)
(4)乙>甲>丙(2分)
28.(6分)(1)![]() (2分) 0.69m<n<m(2分) (3)
(2分) 0.69m<n<m(2分) (3)![]() (2分)
(2分)
29.(1)4×2分 = 8分
| 编号 | a的取值范围 | 产物的化学式(或离子符号) |
| ① | 0 < a ≤ 1/6 | I2 、、Br- |
| ② | 1/6 < a < 1/5 | I2 、Br2、、、 Br- |
| ③ | 1/5 ≤ a < 6/5 | I2、、IO3-、、Br2 |
| ④ | a ≥ 6/5 | IO3- 、Br2 |
(2)( 2分 ) a = 8/15